
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下;

相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是______________________。
(2)反应①和②分别在装置_________________和 __________________中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是____________,优点是用量少,缺点是_____________。
(4)反应②为________________(填“放热”或“吸热”)反应。反应温度控制在50~60℃,温度过高的安全隐患是_______________________。
(5)中和釜D中加入的Z最适宜的是________________________(填编号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔F中的馏出物T和P分别为___________和_____________,判断的依据是__________________。
(7)用该方法合成苯酚和丙酮的优点是____________________________。
【答案】 氧气(或空气) A C 催化剂(提高反应速率) 腐蚀设备 放热 可能会导致(过氧化物)爆炸 c 丙酮 苯酚 苯酚的沸点高于丙酮 原子利用率高
【解析】用异丙苯氧化法生产苯酚和丙酮,由题干的反应信息,异丙苯与氧气在反应器A中发生氧化反应生成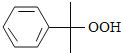 ,在蒸发器中分离出
,在蒸发器中分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在分解釜中在浓硫酸作催化剂条件下分解得到
在分解釜中在浓硫酸作催化剂条件下分解得到![]() 、
、![]() ,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚。
,在中和釜中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚。
(1)在反应器A发生信息中的反应①,故需要氧气或空气,故答案为:氧气或空气;
(2)由上述分析可知,反应①在反应器中发生,即A装置,反应②在分解釜中进行,即C装置,故答案为:A;C;
(3) 在浓硫酸作条件下分解得到
在浓硫酸作条件下分解得到![]() 、
、![]() ,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,故答案为:催化剂;腐蚀设备;
,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备,故答案为:催化剂;腐蚀设备;
(4)反应②的△H<0,为放热反应,有过氧化物存在,温度过高会导致爆炸,反应温度控制在50-60℃,故答案为:放热;温度过高会导致爆炸;
(5)加入Z的目的是中和硫酸,且不能与苯酚反应。a.NaOH能与硫酸、苯酚反应,故不选;b.CaCO3为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故b不选;c.NaHCO3能与硫酸反应,不与苯酚反应,故c选;d.CaO能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故d不选;故选:c;
(6)由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则T为丙酮、P为苯酚,故答案为:丙酮;苯酚;苯酚的沸点高于丙酮;
(7)由异丙苯最终得到苯酚和丙酮,整个过程原子利用率高,故答案为:原子利用率高。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】乙酸和乙醇反应的装置如下图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到饱和碳酸钠溶液的液面上。

(1)饱和碳酸钠溶液的作用是____________________________________;
(2)实验装置中长导管的作用是_____________________________________;
(3)长导管不插入液面以下的目的是___________________________________;
(4)实验中采取的加热方式称__________,这种加热方式的好处主要有_________________;
(5)所制得的酯应从该分液漏斗的__________ (填编号,多填、少填均不得分)。
a.下部流出 b.上口倒出 c.都可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,正极反应为:O2+2H2O+4e﹣═4OH﹣ , 下列叙述不正确的是( )
A.H2通入负极区
B.O2通入正极区
C.负极反应为2H2+4OH﹣﹣4e﹣═4H2O
D.正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学药品要在包装标签上印上警示性标志。下列化学药品名称与警示标志名称对应正确的是( )
A. 酒精——剧毒品 B. 浓硫酸——腐蚀品
C. 汽油——爆炸品 D. 烧碱——剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程图. 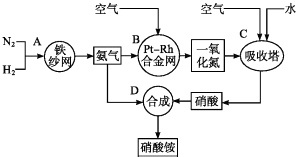
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

(1)铝热法冶炼金属铬,是利用了金属铝的____(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、_______。
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂(O2)的物质的量是____。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是_______。
③已知:2 CrO42-+ 2H+ ![]() Cr2O72-+ H2O K = 4.0×1014
Cr2O72-+ H2O K = 4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_______ mol/L。
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 12.3 | 26.3 | 45.6 | 73.0 | |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:向滤液③中加入稀盐酸和KCl固体,然后_______________、过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知乙醇与浓硫酸混合加热可发生如下反应:CH3CH2OH→CH2-CH2↑+H2O,可看作乙醇分子中脱去一分子水而生成乙烯。
(1)lmol组成为C3H8O的液态有机物A,与足量钠反应生成11.2LH2(标准状况),则A中必有一个_____基,若此基连在碳链的一端,则A的结构简式为_____________。
(2)A与浓硫酸共热也可分子内脱去一分子水而生成B,写出反应的化学方程________________。
(3)B通入溴水中可发生__________反应,该反应的方程式为:___________________。
(4)A在铜丝催化下,加热时与O2反应的化学方程式为:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com