
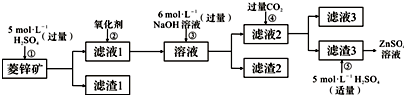
分析 I.由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质;
(2)上述各步骤中,只有步骤①中有二氧化碳生成;
(3)步骤④通二氧化碳将ZnO22-转化为Zn(OH)2;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O;
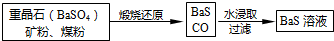
Ⅱ.(5)煅烧发生反应:BaSO4+C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑,根据已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
Ⅲ.(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率.
解答 解:I.由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质,氯气做氧化剂会引入氯离子,且氯气有毒,浓HNO3做氧化剂会被还原为有毒气体,引入杂质离子NO3-,KMnO4 做氧化剂会引入K+、MnO4-,过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热分解生成氧气和水,
故选:D;
(2)上述各步骤中,只有步骤①中有二氧化碳生成,故选:①;
(3)步骤④通二氧化碳将ZnO22-转化为Zn(OH)2,则滤渣3为Zn(OH)2,故答案为:Zn(OH)2;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O,负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O,故答案为:Zn-2e-+4OH-=ZnO22-+2H2O;
Ⅱ.(5)煅烧发生反应:BaSO4+C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑,
已知:①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
依据盖斯定律,②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
Ⅲ.(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率,
故答案为:过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作步骤及试剂的分析评价、电极反应式书写、热化学方程式书写等,理解工艺流程原理是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
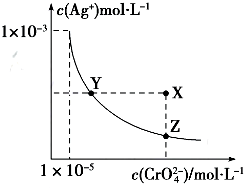
| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com