
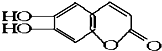
 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )| A. | 3mol Br2;2mol NaOH | B. | 3mol Br2;4mol NaOH | ||
| C. | 2mol Br2;3mol NaOH | D. | 4mol Br2;4mol NaOH |
分析 该物质中含有酯基、酚羟基、苯环、碳碳双键,具有酚、酯和苯的性质,能发生显色反应、氧化反应、取代反应、水解反应及加成反应,酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,以此解答该题.
解答 解:酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,碳碳双键和溴发生加成反应,1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,酯基水解生成的酚羟基和羧基都能和NaOH反应,消耗溴的物质的量为3mol、NaOH的物质的量为4mol,故选B.
点评 本题考查有机物结构和性质,为高考高频点,明确物质官能团及其性质是解本题关键,注意酯基水解生成的酚羟基能和NaOH发生中和反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W |
| A. | W位于第三周期ⅥA族 | |
| B. | 元素最高正价:Z>Y>X | |
| C. | 简单气态氢化物稳定性:W>Y>X | |
| D. | 工业上催化氧化Y的氢化物可用于制备其含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com