
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,甲中充入2mol A和1 mol B,乙中充入2mol C和1mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是
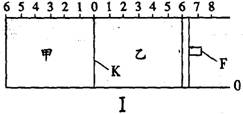

A.达到平衡时,隔板K最终停留在0刻度左侧的0到2之间
B.若达到平衡时,隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C.若达到平衡时,隔板K最终停留在左侧靠近2处,则乙中F最终停留在右侧的刻度大于4
D.如图II所示,若x轴表示时间,则y轴可表示甲、乙两容器中气体的总物质的量或A的物质的量
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||

| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2011年天津市和平区耀华中学高考化学一模试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com