
| A、X一定是金属元素 |
| B、X一定是非金属元素 |
| C、X可能是金属元素,也可能是非金属元素 |
| D、A、B中X的化合价均高于0 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| NH3?H2O | 1.8×10-5 |
| 难溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
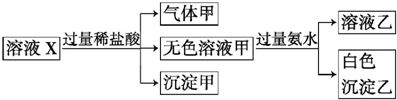
| A、沉淀甲是硅酸和硅酸镁的混合物 |
| B、Na+、AlO2-和SiO32-一定存在于溶液X中 |
| C、气体甲一定是纯净物 |
| D、CO32-和NO3-一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
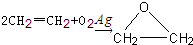
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中一定含有Cu2+ |
| B、溶液中一定含有Fe2+ |
| C、加入KSCN溶液一定不变红色 |
| D、剩余固体中一定含有铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com