
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
分析 调换正负极前后电极反应式如下:调换前:阳极:4OH--4e-=2H2O+O2↑;阴极:2Cu2++4e-=2Cu,
调换后:阳极:2Cu-4e-=2Cu2+(先),4OH--4e-=2H2O+O2↑(后);阴极:2Cu2++4e-=2Cu,
故电路中转移的1.5mol电子中,只有1mol由OH-放电产生,即消耗的n(OH-)=1mol,亦即溶液中积累的n(H+)=1 mol,则c(H+)=0.5mo1•L-1.
解答 解:调换正负极前后电极反应式如下:调换前:阳极:4OH--4e-=2H2O+O2↑;阴极:2Cu2++4e-=2Cu,用惰性电极电解2L1mol/L的CuSO4溶液,分别是 Cu2+和OH-放电,通过0.5mole-,那么0.25molCu2+放电,生成0.25molCu,同时 4OH--4e-=2H2O+O2↑,反应0.5molOH-,得到0.5molH+,
调换后:阳极:2Cu-4e-=2Cu2+(先),4OH--4e-=2H2O+O2↑(后);阴极:2Cu2++4e-=2Cu,
调换正负极,那么通电前的0.5mole-,恰好是电镀铜的过程,也就是第一个过程的Cu又溶解,在另一电极变为Cu,消耗0.5mole-,剩余0.5mole-,还是得到相同的0.5molH+,故电路中转移的1.5mol电子中,只有1mol由OH-放电产生,所以总共得到1molH+,
浓度为0.5mol/L.
故选B.
点评 本题考查电解原理,题目难度中等,本题注意分析调换正负极前后电极反应的变化,为解答该题的关键.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol金属钠含有的电子数 | |
| B. | 0.012 kg 12C中含有的碳原子数 | |
| C. | 1 mol H2SO4完全溶于水后电离出的H+的个数 | |
| D. | 27 g Al与足量稀硫酸反应后生成H2的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
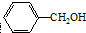 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用分液的方法分离食盐水和汽油的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 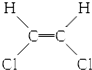 和 和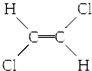 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com