

分析 流程分析可知铝土矿(主要成分是A12O3和Fe2O3)和石油焦在焙烧炉中高温加热反应,得到混合物在氯化炉中高温反应生成氯化铝和一氧化碳,冷却后得到氯化铝固体,升华器中加入铝还原氯化铁,加入氯化钠在升华器中使氯化铝易升华,冷却得到固体氯化铝,
(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、醇液体不需要写出;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO,炉气中含有大量CO和少量C12,可用NaOH(或Na2SO3)溶液除去Cl2,并回收CO;
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3;
(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝;由题目信息可知,AlCl3•6H2O与SOCl2混合加热生成AlCl3、HCl、SO2,据此书写化学方程式.
解答 解:(1)可逆反应3CO(g)+Fe2O3(s)?2Fe(s)+3CO2(g)的化学平衡常数k=$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$,
故答案为:$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$;
(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$ 2A1C13+3CO,炉气中含有大量CO和少量C12,可用NaOH(或Na2SO3)溶液除去Cl2,并回收CO,
故答案为:A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$ 2A1C13+3CO;NaOH(或Na2SO3);
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3,反应方程式为Al+FeCl3$\frac{\underline{\;高温\;}}{\;}$AlCl3+Fe,
故答案为:Al+FeCl3$\frac{\underline{\;高温\;}}{\;}$AlCl3+Fe;
(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝,必须在氯化氢的气流中加热,目的是抑制AlCl3的水解,由题目信息可知,AlCl3•6H2O与SOCl2混合加热生成AlCl3、HCl、SO2,反应方程式为AlCl3•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+12HCl↑+6SO2↑,
故答案为:Al3+发生水解;AlCl3•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+12HCl↑+6SO2↑.
点评 本题考查化学平衡常数、对工艺流程的理解与条件控制、常用化学用语等,难度中等,理解工艺流程是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础,对学生的分析问题、解决问题的能力有较高的要求.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与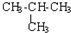 互为同系物 互为同系物 | D. | 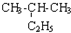 与 与 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com