
| A. |  | B. |  | C. | 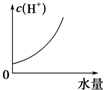 | D. | 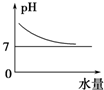 |
分析 25℃时将水不断滴入0.1mol/L的氨水中,一开始起决定因素的是浓度,溶液越稀,PH下降得越快,不呈一次函数是因为氨水是弱碱,越稀越电离,但是浓度起主要作用.在拐点处,浓度不断下降,电离起主要作用.后面PH的变化肯定是越来越慢 因为不管怎么稀释 PH只能越来越接近7却达不到7,所以pH会越降越慢;
A、开始氨水对水的电离起抑制作用;
B、离子浓度下降,导电能力下降;
C、温度一定,溶液中 存在离子积常数,氢氧根离子浓度下降,氢离子浓度增大,最后基本不变;
D、稀释时氢氧根离子浓度下降,pH下降,趋近于7.
解答 解:A、开始氨水对水的电离起抑制作用,所以开始时水的电离程度最小,故A错误;
B、溶液导电能力取决于离子浓度大小,加水稀释离子浓度下降,导电能力下降,故B错误;
C、加水稀释稀氨水,溶液中氢离子浓度增大,当溶液接近中性时,氢离子浓度接近10-7mol/L,故C错误;
D、稀释时氢氧根离子浓度下降,pH下降,趋近于7,不能低于7,故D正确;
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道溶液导电性与离子浓度的关系注意碱无限稀释时溶液接近中性,稀释稀氨水时氢离子增大但不是无限增大,为易错点.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
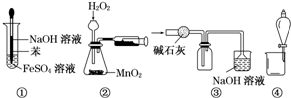
| A. | 图①可以用来制取Fe(OH)2沉淀 | |
| B. | 图②可以用来测定化学反应速率 | |
| C. | 图③可以用来收集一瓶纯净的SO2 | |
| D. | 图④可以用来分离水和乙醇的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (1)(4) | C. | (2)(3) | D. | (2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
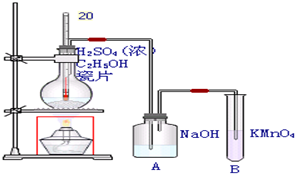
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH-═Na2SiO3+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 鉴定溴乙烷中存在溴元素的实验操作是先加入NaOH溶液,加热后再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 白磷为正四面体分子 | 白磷分子中P-P-P的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com