
【题目】A、D、F均是由短周期元素组成的单质,常温下C是液体, D、F为气体,A、B、E为固体,其中B为淡黄色固体。
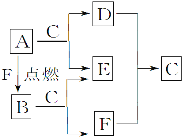
请回答下列问题:
(1)B和E的化学式:B________,E________。
(2)A与C反应的离子方程式为____________________________________________________________。
(3)下列关于A的叙述正确的是________(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应选用泡沫灭火器
(4)将A、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积之比是________(填序号)。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
【答案】Na2O2NaOH2Na+2H2O===2Na++2OH-+H2↑①③
【解析】
A、D、F均是由短周期元素组成的单质,常温下C是液体判断为H2O,A在F中燃烧产物B能和水反应生成单质F,推断F为O2,则A为Na,B为Na2O2,E为NaOH,D为H2。
(1)分析可知B为过氧化钠,E为氢氧化钠。
(2)A与C反应为钠和水反应生成氢氧化钠和氢气。
(3)A为Na是活泼金属、具有很强的还原性,焰色反应为黄色,与水、二氧化碳等发生反应。
(4)钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应,不与水发生反应,据题给信息分析出钠完全反应,而镁、铝过量,据以上分析解答。
A、D、F均是由短周期元素组成的单质,常温下C是液体判断为H2O,A在F中燃烧产物B能和水反应生成单质F,推断F为O2,则A为Na,B为Na2O2,E为NaOH,D为H2;
(1)通过以上分析可知B为过氧化钠,化学式为:Na2O2,E为氢氧化钠,化学式为:NaOH;正确答案:Na2O2 ;NaOH。
(2)A与C反应为钠和水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O===2Na++2OH-+H2↑ ;正确答案:2Na+2H2O=2Na++2OH-+H2↑。
(3)A为Na是活泼金属、具有很强的还原性,焰色反应为黄色,与水、二氧化碳等发生反应;①Na是活泼金属有很强的还原性,故①正确;②Na的焰色反应呈黄色,故②错误;③钠和水剧烈反应,少量Na可以保存在煤油里,故③错误;④钠和二氧化碳能发生反应,Na着火时不能选用泡沫灭火器,故④错误;正确选项①。
(4)钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×12=0.15mol,镁和铝都剩余,所以二者与酸反应生成氢气的量相等,生成根据氢原子守恒得生成氢气的量=0.1mol2=0.05mol,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1;正确选项:③。


科目:高中化学 来源: 题型:
【题目】(1)在下列反应中,水作氧化剂的是________。
A.Cl2+H2O![]() HCl+HClO B.NaH+H2O=NaOH+H2↑
HCl+HClO B.NaH+H2O=NaOH+H2↑
C.3Fe+4H2O(g)![]() Fe3O4 + 4H2 D. H2+CuO
Fe3O4 + 4H2 D. H2+CuO![]() H2O+Cu
H2O+Cu
E. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:__________________。
(3)在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为__________________。
②若X为SiO2,W为CO,该反应在工业的用途是___________________。
(4) 某未知溶液中可能含有Fe2+,确定含该离子的实验方案为:取少量该溶液于试管中,先__________________,再__________________,则说明溶液中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质中杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是
选项 | 物质及其杂质 | 检验 | 除杂 |
A | Na2O2(Na2O) | 水 | 水 |
B | NO(NO2) | 观察颜色 | 水 |
C | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
D | HCl(Cl2) | 观察颜色 | 排饱和食盐水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
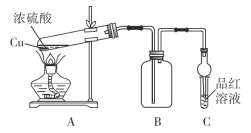
甲组取a g铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余。
(1)写出装置A中所发生反应的化学方程式:_______________________________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2:______(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是_____________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组同学设计了最简单方法给予解决:在C试管口塞上一团沾有_________(填化学式)溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是_______。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是21世纪化学发展的主导方向,其核心是化学反应或化工生产中尽量减少或彻底消除使用和产生有害物质。下列制备硫酸铜方案中,可行且符合“绿色化学”理念的是
A. 加热条件下,用铜粉和稀硫酸反应
B. 加热条件下,用铜粉与浓硫酸反应
C. 先灼烧铜粉,再将其与稀硫酸反应
D. 常温条件下,用铜粉与硫酸亚铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】善于归纳元素及其化合物之间的转化关系,对学习元素化合物具有重要意义。现有下列物质:金属铁、钠、镁、氯气、氧气、二氧化硫、二氧化碳、水、NaOH溶液、氨水、HCl溶液、KI溶液、HNO3溶液、FeCl2溶液。根据要求回答问题:
(1)置换反应是中学常见基本反应类型之一。
①写出非金属单质置换出非金属单质的离子方程式______________________。
②写出金属单质置换出非金属单质的化学反应方程式______________________。
(2)“三角转化”是单质及其化合物间常见的转化关系之一。现有如图转化关系:
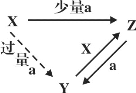
①若X是一种强碱,a是一种酸性氧化物,则Z为_________盐(填“正”或“酸式”)。
②若Z是一种能够与血红蛋白结合造成人体缺氧的气体,则a的名称为___________。
③若X是常见金属单质,a为含氧酸,则Z中金属元素的化合价为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com