
| A、Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| D、NaHCO3溶液与NaOH溶液:HCO3-+OH-═CO32-+H2O |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、某无色溶液中加入AgNO3溶液得白色沉淀,加稀硝酸沉淀不消失,则原液一定存在Cl- |
| B、某无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸沉淀不溶解,则一定含有SO42- |
| C、提纯含有少量Ba(NO3)2杂质的KNO3,可加入过量的K2SO4溶液,过滤,再向滤液中滴加适量的稀硝酸 |
| D、某无色溶液中滴加入盐酸则生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①是把饱和食盐水中的食盐提取出来 |
| B、装置②用100mL量筒量取9.5mL液体 |
| C、装置③中X若为CCl4,可用于吸收NH3或HCl,并可防止倒吸 |
| D、装置④可用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、②③④ |
| C、②④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 |
| B、NH3是一种碱,能使湿润的红色石蕊试纸变蓝 |
| C、少量的CO2通入BaCl2溶液中会产生白色沉淀 |
| D、SO2能使酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
| C、CH3CH2CH2CH2CH2OH |
| D、CH3CH2CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
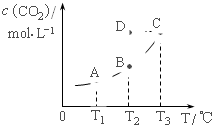 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )| A、平衡状态A与C相比,平衡状态A的c(CO)小 |
| B、在T2时,若反应处于状态D,则一定有V正<V逆 |
| C、反应CO(g)+H2O(g)?CO2(g)+H2(g) 的△H>0 |
| D、若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com