
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
(1)a>b=c (2)c>a=b (3)a>b>c c>a=b
解析试题分析:(1)醋酸是一元弱酸,部分电离;一元强酸盐酸和二元强酸硫酸是完全电离的。当溶液的PH相等时,C(H+)相等,n(CH3COOH)>n(HCl)=2n(H2SO4)。最终可产生的H+的物质的量n(CH3COOH)>n(HCl)= n(H2SO4)。所以分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是a>b=c。(2)在同体积、同物质的量浓度的三种酸中,也就是n(CH3COOH)=n(HCl)= n(H2SO4)。最终产生的H+的物质的量为n(H2SO4)>n(CH3COOH)=n(HCl)。故分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是c>a=b。(3)H2SO4是二元强酸,完全电离;HCl是一元强酸也完全电离;CH3COOH一元弱酸,部分电离,当三者浓度相等时,H+的浓度物质的量浓度n(H2SO4)>n(HCl)>n(CH3COOH)。H+的浓度越大,溶液的酸性就越强,PH就越小。个浓度均是0.1mol/L的三种酸溶液的pH由大到小的顺序是a>b>c。如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,H2SO4能产生的H+的物质的量是HCl的二倍,消耗NaOH溶液的体积也是HCl的二倍。尽管盐酸是强酸,醋酸是弱酸,但由于二者的浓度相等,体积相等,物质的量就相等,中和碱的能力也相等。所以反应消耗NaOH的体积由大到小的顺序是c>a=b。
考点:考查醋酸、盐酸、硫酸三种酸在相同浓度或相同PH时与其它物质反应时的情况的知识。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:填空题
已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。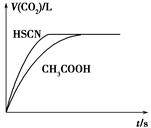
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。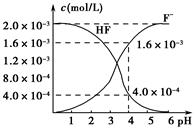
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”“=”或“<”)。
(3)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: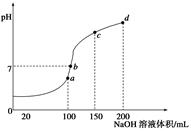
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数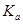 =____________mol/L。
=____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.10mol/L醋酸溶液、pH=3的盐酸、pH=3的醋酸、NaAC晶体、NaCL晶体、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 (用“等式”或“不等式”表示)
(3)丙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(填“正确”或“不正确”)
(4)丁将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
(5)戊取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下。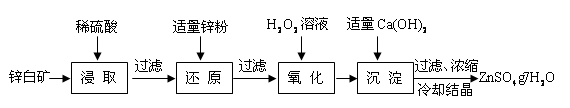
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com