
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量CH3COONa固体,平衡向正反应方向移动 |
| C、加入少量0.1mol?L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大 |
| D、加入少量NaOH固体,平衡向正反应方向移动 |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| A、②③④ | B、①③④ |
| C、①③⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26Mg2+含有的中子数和电子数 |
| B、反应2Na2O2+2H2O═4NaOH+O2↑中,还原剂与氧化剂的物质的量 |
| C、惰性电极电解Na2SO4溶液,阴、阳两极析出物质的物质的量 |
| D、液面在0刻度时,50mL滴定管25mL滴定管所盛溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3在水溶液中的电离方程式:H2SO3═2H++SO32- |
| B、CO32-在水溶液中的水解方程式:CO32-+2H2O═H2CO3+2OH- |
| C、碳酸钙溶于盐酸中:CO32-+2H+=H2O+CO2↑ |
| D、Al3+在水溶液中的水解方程式:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和浓溴水用铁作催化剂制溴苯 |
| B、向装有MnO2的烧瓶中滴加浓盐酸制Cl2 |
| C、淀粉与质量分数为20%的硫酸共煮制单糖 |
| D、电石与水反应在启普发生器中进行制乙块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
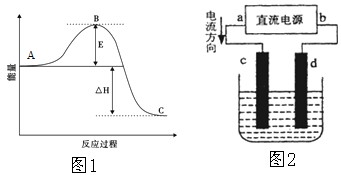
| 7 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
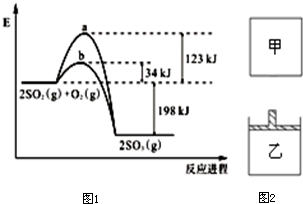 已知 2mol SO2(g)氧化为2mol SO3(g) 的能量变化如图1所示:
已知 2mol SO2(g)氧化为2mol SO3(g) 的能量变化如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,可在现场喷洒NaOH溶液 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com