
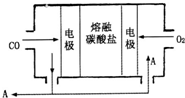
 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| 4.48L |
| 22.4L/mol |


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
| A、氯水通过SO2后溶液的酸性增强 |
| B、向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀 |
| C、Na、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| D、浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
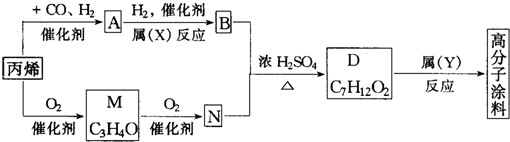
查看答案和解析>>
科目:高中化学 来源: 题型:
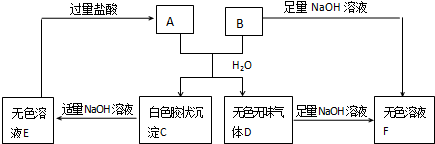
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
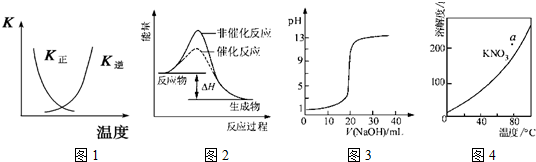
| A、图1表示该可逆反应平衡后,随温度升高,平衡会逆向移动 |
| B、图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C、图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液所得到的滴定曲线 |
| D、图4表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
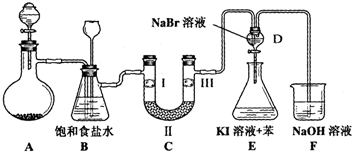
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
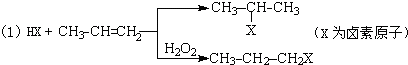
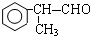 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| C | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
| D | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com