
| A | | R | |||||||||||||||
| B | | | | | | | | | | | | C | D | E | F | T | |
| G | H | I | J | | K | L | | ||||||||||
| | | | | | M | | N | | | | | | | | | | |
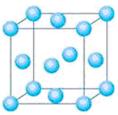


科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B.乳酸(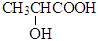 )存在对映异构体,因为其分子中含有一个手性碳原子 )存在对映异构体,因为其分子中含有一个手性碳原子 |
C.在NH3分子中存在极性共价键和配位键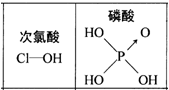 |
| D.由上图知酸性:H3PO4>HClO,因为H3PO4分子中有非羟基氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
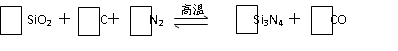


 。例如:
。例如: +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点 | 920 | 801 | 1291 | 190 | —107 | 2073 | —57 | 1723 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑥ | B.③④ | C.④⑤ | D.①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com