
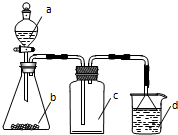
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )| 选项 | a中物质 | b中物质 | c中的气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO | H2O |
| C | 硫酸 | Na2CO3 | CO2 | NaOH溶液 |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据装置图可知所制备的气体应为固体和液体不加热制备,并用向上排空气法收集以及采用防倒吸的方法进行尾气处理,根据各选项中反应物的状态判断发生装置、气体的性质以及是否除杂等角度解答本题.
解答 解:A、氨气的密度比空气小,c装置中应该短管进,长管出,故A错误;
B、铜与稀硝酸反应产生的气体为NO,NO不能用排空气法收集,水不能完全吸收,故B错误;
C、硫酸可以与碳酸钠反应,生成二氧化碳,CO2气体的密度比空气大,c装置中应该长管进,短管出,剩余二氧化碳气体可以用氢氧化钠溶液吸收尾气,装置符合制备、收集和吸收的要求,故C正确;
D、浓盐酸与MnO2制氯气需要加热,且由于浓盐酸易挥发,所以c中收集的气体不纯净,应该在bc之间应添加除去氯化氢的装置,剩余其用氢氧化钠溶液吸收,故D错误;
故选C.
点评 本题考查化学实验基本原理(气体的制备),实验装置、仪器的使用,题目难度不大,掌握物质的性质即可解答.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 略大于20% | C. | 略小于20% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 除去溴水中的少量溴化钠 | 加入乙醇,震荡,静置,分液,取出上层液体 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为1:1时,反应达到平衡 | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com