
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A.温度升高,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大
科目:高中化学 来源: 题型:
如图是某同学设计的原电池装置,下列叙述中正确的是( )

|
| A. | 电极Ⅰ上发生还原反应,作原电池的负极 |
|
| B. | 电极Ⅱ的电极反应式为:Cu2++2e﹣=Cu |
|
| C. | 该原电池的总反应为:2Fe3++Cu=Cu2++2Fe2+ |
|
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率比乙容器内的反应速率
A.快 B.慢 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4
【I】甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ②分别投入大小、形状相同的铜、铁、镁 | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。
【II】乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验。
(2)乙同学在实验中应该测定的数据是 。
(3)乙同学完成该实验应选用的实验药品 。不选用某浓度的硫酸,理由是 。
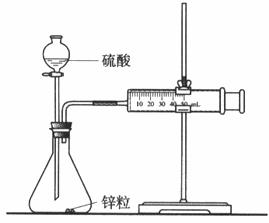
测量锌与硫酸反应速率的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) H<0,则该反应一定不能自发进行
D.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线,如图2所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
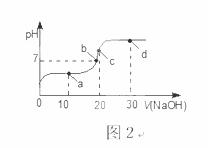
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -)
B.b点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C.c点时:c(OH-)=c(CH3COOH) +c(H+)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实可以用同一反应原理解释的是( )
A.活性炭、氯气都能使品红溶液退色
B.乙酸、葡萄糖都能与新制Cu(OH)2悬浊液反应
C.乙烯、氯乙烯都能使溴水退色
D.淀粉、蛋白质都能发生显色(或颜色)反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com