
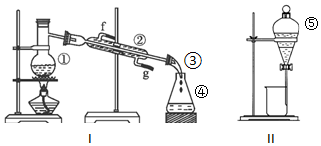
分析 (1)①②④⑤分别是蒸馏烧瓶、冷凝管、锥形瓶、分液漏斗;
(2)蒸馏时需要控制温度;沸石有防暴沸的作用;冷凝管中的水流采用逆流方式;
(3)分离互不相溶的液体采用分液方法,含有活塞的仪器在使用前必须检查装置的气密性;
(4)互溶的液体采用蒸馏方法分离提纯.
解答 解:(1)根据仪器图象知,)①②④⑤分别是蒸馏烧瓶、冷凝管、锥形瓶、分液漏斗,
故答案为:①蒸馏烧瓶(圆底烧瓶);②冷凝器;④锥形瓶;⑤分液漏斗;
(2)蒸馏时需要控制温度,所以还需要测量温度的温度计;沸石有防暴沸的作用,防止液体剧烈沸腾而产生安全事故;冷凝管中的水流采用逆流方式,所以g是进水口、h是出水口,
故答案为:温度计;防暴沸;g;
(3)该操作是分液,适用于分离互不相溶的液体,含有活塞的仪器在使用前必须检查装置的气密性,分液漏斗中含有活塞,为防止实验失败,在使用前必须检验气密性,
故答案为:分液;检验装置的气密性;
(4)石油中各成分互溶且是液体,应该采用蒸馏的方法,故选I.
点评 本题考查物质分离提纯实验方案设计,为高频考点,涉及仪器选取、物质分离提纯等知识点,明确物质性质差异性是解本题关键,会根据物质性质选取合适的分离提纯方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
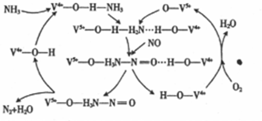

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
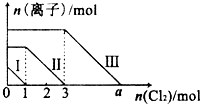 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
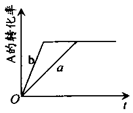 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com