
某化学兴趣小组学习原电池知识后,决定用其原理,尝试利用铁粉、活性炭、无机盐等物质开发产品.小组提出的设想或对原理的理解不正确的是()
A. 打算制成小包装用于糕点的脱氧剂
B. 利用反应放出热量的原理制成暖宝宝
C. 调整电池结构,可降低温度,可用于延长糕点保质期
D. 正极的电极反应为:2H2O+O2+4e﹣=4OH﹣
考点: 原电池和电解池的工作原理;常见的食品添加剂的组成、性质和作用.
专题: 电化学专题.
分析: 铁粉、活性炭、无机盐等形成原电池反应,铁为负极,被氧化生成Fe2+,正极上氧气得电子被还原,电极方程式为2H2O+O2+4e﹣=4OH﹣,以此解答该题.
解答: 解:A.铁为负极,被氧化生成Fe2+,Fe2+具有还原性,可制成小包装用于糕点的脱氧剂,故A正确;
B.铁与氧气、水形成原电池反应,铁生锈的过程是放热反应,故B正确;
C.反应放热,不能降低温度,故C错误;
D.正极上氧气得电子被还原,电极方程式为2H2O+O2+4e﹣=4OH﹣,故D正确.
故选C.
点评: 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的特点和工作原理,难度不大,注意相关基础知识的积累.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是()
A. 质子数c>b B. 离子的还原性Y2﹣>Z﹣
C. 氢化物的稳定性H2Y>HZ D. 原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
B. 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
C. 过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
D. S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
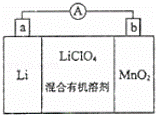
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原 理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
(1)外电路的电流方向是由b极流向 极(填字母).
(2)电池正极反应式 .
(3)是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是 .
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 .K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的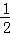 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
A. m+n>p B. 平衡向逆反应方向移动
C. A的转化率提高 D. C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005mol/(L•s).下列说法正确的是()
A. 4s时c(B)为0.76mol/L
B. 830℃达平衡时,A的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
 D. 1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的值为0.
D. 1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的值为0. 4
4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.0g AO32﹣中核外电子数比质子数多6.02×1022个,下列说法中正确的是( )
|
| A. | A原子的摩尔质量32g/mol |
|
| B. | AO32﹣的摩尔质量为60 |
|
| C. | 3.0g AO32﹣ 的物质的量是0.02mol |
|
| D. | A元素的相对原子质量为12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到标况气体6.72L,并测得溶液的C(H+)=1moL/L,假设反应后溶液的体积仍为80mL,计算:
(1)被还原的硝酸的物质的量.
(2)合金中银的质量分数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com