
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
¢ŁÕż³£ÓźĖ®µÄpHĪŖ7.0£¬ĖįÓźµÄpHŠ”ÓŚ7.0£»
¢ŚŃĻøńÖ“ŠŠ»ś¶Æ³µĪ²ĘųÅŷűź×¼ÓŠĄūÓŚ·ĄÖ¹“óĘųĪŪČ¾£»
¢ŪŹ¹ÓƶžŃõ»ÆĮņŗĶijŠ©ŗ¬Įņ»ÆŗĻĪļŌö°×µÄŹ³Ę·»įĖšŗ¦ČĖĢ彔浣»
¢ÜŹ¹ÓĆĀČĘų¶Ō×ŌĄ“Ė®Ļū¶¾æÉÄܶŌČĖĢåÓŠŗ¦£»
¢ŻŹ³Ę·³§²śÉśµÄŗ¬·įø»µŖ”¢Į×ÓŖŃųĖŲµÄ·ĻĖ®æɳ¤ĘŚÅÅĻņŃųÓćĖ®æā
¢ŽČĖŌģøÕÓńČŪµćŗÜøߣ¬æÉÓĆ×÷øß¼¶ÄĶ»š²ÄĮĻ£¬Ö÷ŅŖ³É·ÖŹĒAl2O3
¢ßŌŚŅ½ĮĘÉĻĢ¼ĖįĒāÄĘæÉÓĆÓŚÖĪĮĘĪøĖį¹ż¶ą
¢ą·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹĮ£×ÓµÄÖ±¾¶£ŗFe(OH)3Šü×ĒŅŗ>Fe(OH)3½ŗĢå>FeCl3ČÜŅŗ
A.¢Ś¢Ū¢Ż¢Ž¢ß¢ąB.¢Ł¢Ü¢Ż¢Ž¢ą
C.¢Ś¢Ū¢Ü¢Ž¢ß¢ąD.¢Ū¢Ü¢Ż¢ß¢ą
”¾“š°ø”æC
”¾½āĪö”æ
![]() Õż³£ÓźĖ®µÄpHŌ¼ĪŖ
Õż³£ÓźĖ®µÄpHŌ¼ĪŖ![]() £¬ĖįÓźµÄpHŠ”ÓŚ
£¬ĖįÓźµÄpHŠ”ÓŚ![]() £¬¹Ź
£¬¹Ź![]() “ķĪó£»
“ķĪó£»
![]() ŃĻøńÖ“ŠŠ»ś¶Æ³µĪ²ĘųÅŷűź×¼æɼõÉŁ“óĘųĪŪČ¾ĪļCO”¢NOµÄÅÅ·Å£¬ÓŠĄūÓŚ·ĄÖ¹“óĘųĪŪČ¾£¬¹Ź
ŃĻøńÖ“ŠŠ»ś¶Æ³µĪ²ĘųÅŷűź×¼æɼõÉŁ“óĘųĪŪČ¾ĪļCO”¢NOµÄÅÅ·Å£¬ÓŠĄūÓŚ·ĄÖ¹“óĘųĪŪČ¾£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
![]() ¶žŃõ»ÆĮņ¶ŌČĖĢåÓŠŗ¦£¬²»ÄÜÓĆĄ“ĘÆ°×Ź³Ę·£¬¹Ź
¶žŃõ»ÆĮņ¶ŌČĖĢåÓŠŗ¦£¬²»ÄÜÓĆĄ“ĘÆ°×Ź³Ę·£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
![]() ĀČĘųÄÜÓėÓŠ»śĪļ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĀČ»ÆĪļ¶ŌČĖĢåÓŠŗ¦£¬¹Ź
ĀČĘųÄÜÓėÓŠ»śĪļ·¢Éś·“Ó¦£¬Éś³ÉµÄÓŠ»śĀČ»ÆĪļ¶ŌČĖĢåÓŠŗ¦£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
![]() ŗ¬·įø»µŖ”¢Į×ÓŖŃųĖŲµÄ·ĻĖ®æɵ¼ÖĀĖ®µÄø»ÓŖŃų»Æ£¬²»ÄÜĖęŅāÅÅ·Å£¬¹Ź
ŗ¬·įø»µŖ”¢Į×ÓŖŃųĖŲµÄ·ĻĖ®æɵ¼ÖĀĖ®µÄø»ÓŖŃų»Æ£¬²»ÄÜĖęŅāÅÅ·Å£¬¹Ź![]() “ķĪó£»
“ķĪó£»
![]() Ńõ»ÆĀĮ¾ßÓŠŗÜøßµÄČŪµć£¬ŹĒČĖŌģøÕÓńµÄ³É·Ö£¬¹Ź
Ńõ»ÆĀĮ¾ßÓŠŗÜøßµÄČŪµć£¬ŹĒČĖŌģøÕÓńµÄ³É·Ö£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
![]() Ģ¼ĖįĒāÄĘæÉŅŌŗĶŃĪĖį·“Ӧɜ³ÉĀČ»ÆÄĘ”¢Ė®ŅŌ¼°¶žŃõ»ÆĢ¼£¬æÉŅŌÓĆĄ“ÖŠŗĶĪøĖį£¬¹Ź
Ģ¼ĖįĒāÄĘæÉŅŌŗĶŃĪĖį·“Ӧɜ³ÉĀČ»ÆÄĘ”¢Ė®ŅŌ¼°¶žŃõ»ÆĢ¼£¬æÉŅŌÓĆĄ“ÖŠŗĶĪøĖį£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
![]() ·ÖÉ¢ÖŹĪ¢Į£Ö±¾¶£ŗŠü×ĒŅŗ
·ÖÉ¢ÖŹĪ¢Į£Ö±¾¶£ŗŠü×ĒŅŗ![]() ½ŗĢå
½ŗĢå![]() ČÜŅŗ£¬¹ŹF
ČÜŅŗ£¬¹ŹF![]() Šü×ĒŅŗ
Šü×ĒŅŗ![]() ½ŗĢå
½ŗĢå![]() ČÜŅŗ£¬¹Ź
ČÜŅŗ£¬¹Ź![]() ÕżČ·£»
ÕżČ·£»
Ń”C”£


 Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø
Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖij»Æѧ·“Ó¦A2(g)£«2B2(g)=2AB2(g)(A2”¢B2”¢AB2µÄ½į¹¹Ź½·Ö±šĪŖ A===A”¢B”ŖB”¢B”ŖA”ŖB)£¬ÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹöÖŠÕżČ·µÄŹĒ(””””)

A. øĆ·“Ó¦µÄ½ųŠŠŅ»¶ØŠčŅŖ¼ÓČČ»ņµćČ¼Ģõ¼ž
B. øĆ·“Ó¦ČōÉś³É2molAB2(g)Ōņ·Å³öµÄČČĮæĪŖ (E1£E2) kJ
C. øĆ·“Ó¦¶ĻæŖ»Æѧ¼üĻūŗĵÄ×ÜÄÜĮæ“óÓŚŠĪ³É»Æѧ¼üŹĶ·ÅµÄ×ÜÄÜĮæ
D. Éś³É2 mol B”ŖA¼ü·Å³öE2 kJÄÜĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶Ō·“Ó¦A£Øs£©+3B£Øg£©![]() 2C£Øg£©+D£Øg£©Ą“Ėµ£¬ĻĀĮŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£Ø””””£©
2C£Øg£©+D£Øg£©Ą“Ėµ£¬ĻĀĮŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£Ø””””£©
A. v£ØA£©=0.02 mol/£ØLs£© B. v£ØB£©=0.6 mol/£ØLmin£©
C. v£ØC£©=0.5 mol/£ØLmin£© D. v£ØD£©=0.01 mol/£ØLs£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)¾ö¶Ø»Æѧ·“Ó¦ĖŁĀŹµÄÖ÷ŅŖŅņĖŲŹĒ²Ī¼Ó·“Ó¦µÄĪļÖŹµÄ________£¬Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄĶāŅņÓŠ_______________________(ÖĮÉŁĢī2øö)£»
(2)H2C2O4ÓėKMnO4·“Ó¦Ź±£¬Ėü×Ŗ»ÆĪŖCO2ŗĶH2O”£ŹµŃéĻÖĻó________________
(3)ĒāŃõ»Æ±µ¾§ĢåBa(OH)2”¤8H2OÓėĀČ»Æļ§·“Ó¦·½³ĢŹ½_________________”£
(4)Na2S2O3ÓėĻ”H2SO4·“Ó¦Ąė×Ó·½³ĢŹ½_______________________”£
(5)½«Ļņŗ¬ÓŠKIŗĶH2SO4µÄ»ģŗĻČÜŅŗÖŠ¼ÓČėµķ·ŪČÜŅŗ£¬·ÅÖĆŅ»¶ĪŹ±¼äŹµŃéĻÖĻó”£________
(6)ŌŚH2O2ČÜŅŗÖŠ¼ÓČėÉŁĮæMnO2ŹµŃéĻÖĻó____________
(7)µ±1 g°±ĘųĶźČ«·Ö½āĪŖµŖĘų”¢ĒāĘųŹ±£¬ĪüŹÕ2.72 kJµÄČČĮ棬ŌņČČ»Æѧ·½³ĢŹ½_______________
(8)ÓɽšŗģŹÆ(TiO2)ÖĘČ”µ„ÖŹTi£¬Éę¼°µÄ²½ÖčĪŖ£ŗTiO2”śTiCl4+Mg”śTi”£ŅŃÖŖ£ŗ
¢ŁC(s)+O2(g)=CO2(g) ¦¤H1=£393.5 kJ/mol
¢Ś2CO(g)+O2(g)=2CO2(g) ¦¤H2=£566 kJ/mol
¢ŪTiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ¦¤H3=+141 kJ/mol
ŌņTiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)µÄ¦¤H=__________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢ZČżÖÖ³£¼ūŌŖĖŲµÄµ„ÖŹ£¬¼×”¢ŅŅŹĒĮ½ÖÖ³£¼ūµÄ»ÆŗĻĪļ£¬Ļą»„¼äÓŠČēĻĀĶ¼×Ŗ»Æ¹ŲĻµ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
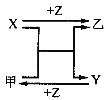
(1)ČōX»łĢ¬Ō×ÓĶāĪ§µē×ÓÅŲ¼Ź½ĪŖ3s2£¬¼×ŹĒÓɵŚ¶žÖÜĘŚĮ½ÖÖŌŖĖŲµÄŌ×Ó¹¹³ÉµÄ·Ē¼«ŠŌĘųĢ¬·Ö×Ó£¬YŌ×ӵĵē×ÓÅŲ¼Ķ¼ĪŖ_________£¬ŅŅµÄµē×ÓŹ½ĪŖ________£»
(2)ČōXĪŖ·Ē½šŹō£¬¼×ŹĒÓÉĮ½ÖÖ¶ĢÖÜĘŚŌŖĖŲµÄŌ×Ó¹¹³ÉµÄA2BŠĶ¼«ŠŌ·Ö×Ó£¬ĒŅŹĒ³£¼ūµÄČܼĮ£¬¼×µÄµē×ÓŹ½___£¬ŅŅµÄ»ÆѧŹ½ĪŖ_____£»
(3)ČōX”¢Y¾łĪŖ½šŹōµ„ÖŹ£¬X»łĢ¬Ō×ÓĶāĪ§µē×ÓÅŲ¼Ź½ĪŖ3s23p1£¬¼×ĪŖ¾ßÓŠ“ÅŠŌµÄŗŚÉ«¹ĢĢ壬ŌņXÓė¼×·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚÄ³Ņ»ČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬A”¢B”¢C”¢DĖÄÖÖĪļÖŹµÄĪļÖŹµÄĮæn£Ømol£©Ėꏱ¼ät£Ømin£©µÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ

Ķź³ÉĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________”£
£Ø2£©Ē°2 minÓĆAµÄÅØ¶Č±ä»Æ±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ______________”£
ŌŚ2 minŹ±£¬Ķ¼Ļń·¢ÉśøıäµÄŌŅņæÉÄÜŹĒ________£ØÓĆ×ÖÄø±ķŹ¾£©”£
A£®Ōö“óŃ¹Ēæ B£®½µµĶĪĀ¶Č
C£®¼ÓČė“߻ƼĮ D£®Ōö¼ÓAµÄĪļÖŹµÄĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚ·“Ó¦![]() ”£²ÉČ”ĻĀĮŠ“ėŹ©ÄܼÓæģ·“Ó¦ĖŁĀŹµÄŹĒ( )
”£²ÉČ”ĻĀĮŠ“ėŹ©ÄܼÓæģ·“Ó¦ĖŁĀŹµÄŹĒ( )
¢ŁÉżĪĀ ¢ŚŗćČŻĻĀĶØČė¶čŠŌĘųĢå ¢ŪŌö¼Ó![]() µÄÅØ¶Č ¢Ü¼õŃ¹ ¢Ż¼Ó“߻ƼĮ ¢ŽŗćŃ¹ĻĀĶØČė¶čŠŌĘųĢå
µÄÅØ¶Č ¢Ü¼õŃ¹ ¢Ż¼Ó“߻ƼĮ ¢ŽŗćŃ¹ĻĀĶØČė¶čŠŌĘųĢå
A.¢Ł¢Ś¢ŻB.¢Ł¢Ū¢ŻC.¢Ś¢Ü¢ŽD.¢Ū¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ«·°Ńõ»Æ»¹ŌŅŗĮ÷µē³ŲŹĒŅ»ÖÖŠĀŠĶĀĢÉ«µÄ¶ž“Īµē³Ų”£Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
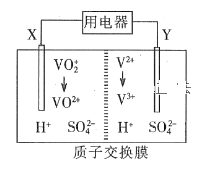
A.·ÅµēŹ±£¬µē×ÓÓÉY¼«Į÷³ö£¬¾ÖŹ×Ó½»»»Ä¤µ½X¼«
B.·Åµē¹ż³ĢÖŠ£¬µē½āÖŹČÜŅŗpH½µµĶ
C.³äµēŹ±£¬X¼«·“Ó¦Ź½ĪŖ£ŗVO2++H2O -e- = VO2++2H+
D.·ÅµēŹ±£¬Ćæ×ŖŅĘ1 molµē×ÓĄķĀŪÉĻÓŠ2 mol H£«Óɽ»»»Ä¤ÓŅ²ąĻņ×ó²ąĒØŅĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖĪŅ¹śŌ²Ć÷Ō°ŹŽŹ×ĶĻń”ŖĶĆŹ×ŗĶŹóŹ×£¬æ“ÉĻČ„ČŌģŚģŚÉś»Ō”£ĻĀĮŠ¶ŌĘäŌŅņµÄ·ÖĪö×īæÉÄܵďĒ£Ø £©

A.ĖüĆĒ±ķĆęµÄĶĀĢŅŃÓĆĖįŠŌČÜŅŗĻ“Č„B.ĄūÓƵē¶ĘŌĄķŌŚĘä±ķĆę¶ĘĮĖŅ»²ćÄĶøÆŹ“µÄ»Ę½š
C.ĶµÄ»ī¶ÆŠŌŗÜČõ£¬ÓėæÕĘų³É·Ö²»·“Ó¦D.ĖüĆĒŹĒŗ¬Ņ»¶Ø±ČĄż½š”¢Ņų”¢Īż”¢ŠæµÄĶŗĻ½š
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com