
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:
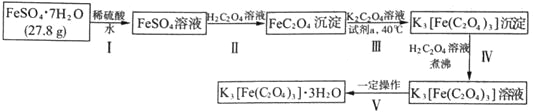
回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
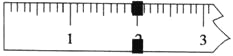
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。
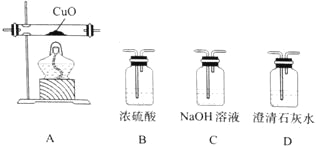
按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
【答案】抑制Fe2+水解 Fe2++ H2C2O4![]() FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
【解析】
(1) 步骤Ⅰ中:亚铁离子在水溶液中水解:Fe2++2H2O![]() Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
在步骤I制备的溶液中加入25mL饱和H2C2O4溶液,搅拌并加热煮沸,晶体颗粒长大形成黄色FeC2O42H2O沉淀,离子方程式为Fe2++ H2C2O4![]() FeC2O4↓+2H+;
FeC2O4↓+2H+;
Fe2++ H2C2O4![]() FeC2O4↓+2H+的平衡常数K=
FeC2O4↓+2H+的平衡常数K=![]() ,
,
根据H2C2O4![]() H++ HC2O4-,HC2O4-
H++ HC2O4-,HC2O4-![]() H++ C2O42-,
H++ C2O42-,
K1=![]() ,K2=
,K2=![]()
根据的溶解平衡方程式:FeC2O4![]() Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
可知,K=![]() =
=![]() =14.4,
=14.4,
故答案为:抑制Fe2+水解;Fe2++ H2C2O4![]() FeC2O4↓+2H+;14.4;
FeC2O4↓+2H+;14.4;
(2)为了不引入杂质,将FeC2O4氧化为K3[Fe(C2O4)3],最好需要双氧水,
故选选c;
(3)根据题意和图示,制得晶体的质量为21.9g;27.8gFeSO4·7H2O的物质的量为![]() =0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为
=0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为![]() ×100%=44.6%,
×100%=44.6%,
故答案为:21.9;44.6%;
(4)二氧化碳能够是澄清石灰水变浑浊,一氧化碳具有还原性,被氧化生成二氧化碳,因此首先检验二氧化碳,除净二氧化碳后再检验一氧化碳,从左到右,装置的连接顺序为DCDBAD,当看到第一个澄清石灰水变浑浊,证明有二氧化碳,当看到A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊,证明有一氧化碳,
故答案为:DCDBAD;A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.足量的Fe在Cl2中燃烧只生成FeCl3
B.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C.向一瓶未知的近无色溶液中加入KSCN再加入几滴氯水,溶液变红,溶液中一定含有FeCl2
D.向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液只含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):
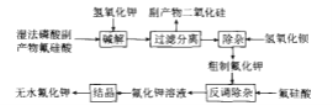
请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。
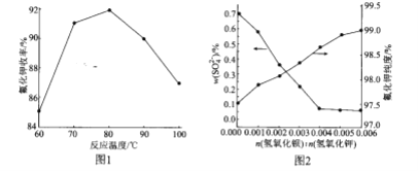
(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成nmol O2的同时生成2nmol NO2;
②单位时间内生成nmol O2 的同时生成2nmol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤密闭容器中压强不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑤⑥B. ②③⑤⑥C. ①③④⑥D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。
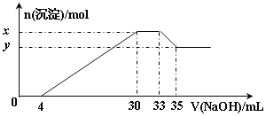
下列叙述不正确的是( )
A.原溶液中c(Cl-)=0.75 mol·L-1
B.x与y的差值为0.01 mol
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
甲叉琥珀酸,又名亚甲基丁二酸,在精细化工领域有着广泛的用途,其合成路线如下: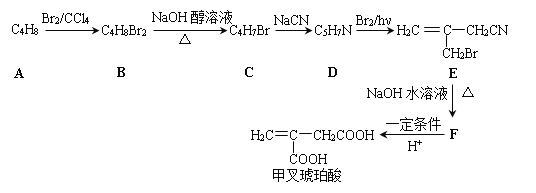
已知:![]()
回答下列问题:
(1)甲叉琥珀酸中官能团的名称为_______,_______。
(2)A的名称为_______,A→B的化学方程式为_______。
(3)B→C的化学方程式为_______,C→D的反应类型为_______。
(4)F的结构简式为_______。
(5)甲叉琥珀酸的同分异构体M也是不饱和二元羧酸,则M共有 _______种(不考虑立体异构),其中核磁共振氢谱显示三组峰,且峰面积之比为3∶1∶2的结构简式为 _______。
(6)根据上述信息,写出用一氯甲苯(![]() CH2Cl)为原料(无机试剂任选)制备苯乙酸(
CH2Cl)为原料(无机试剂任选)制备苯乙酸(![]() CH2COOH)的合成路线_______。
CH2COOH)的合成路线_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com