
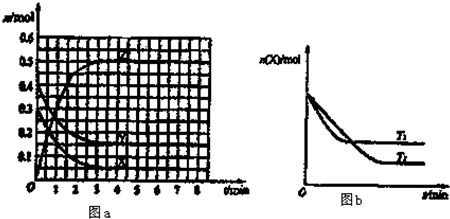
| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
| △C |
| △t |
| △C |
| △t |
| ||
| 3min |
| 0.25mol/L |
| 0.4mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Zn>Cu>Ag |
| B、Zn>Ag>Cu |
| C、Cu>Ag>Zn |
| D、Ag>Cu>Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水显碱性:NH3?H2O═NH4++OH- |
| B、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| C、硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- |
| D、AlCl3溶液显酸性:Al3++3H2O?Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3、HCl、CaCl2 |
| B、Na2CO3、HNO3、MgSO4 |
| C、Na2CO3、HCl、Ba(NO3)2 |
| D、H2SO4、Na2CO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com