
| ① | ② | ③ | 实验结论 |  | |
| A | 饱和食盐水 | 电石 | 溴水 | 乙炔和溴水发生加成反应 | |
| B | 浓盐酸 | KMnO4 | FeCl2溶液 | 氧化性:MnO4->Cl2>Fe3+ | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
(1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.| 晶格能/kJ?mol-1 | 熔点/℃ | |
| CaO | 3401 | 2927 |
| KCl | 699 | 772 |
| KBr | 689 | 734 |
| KI | 632 | 680 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL0.5mol?L-1Mg(NO3)2溶液 |
| B、200mL1mol?L-1Ca(NO3)2溶液 |
| C、50mL1mol?L-1NaNO3溶液 |
| D、25mL0.5mol?L-1HNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
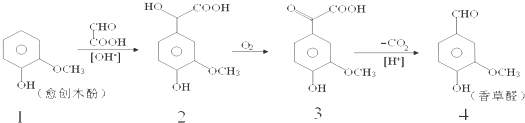
| A、反应1→2中原子利用率为90% |
| B、检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 |
| C、化合物2在一定条件下可发生酯化反应 |
| D、等物质的量四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比1:4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R形成的盐一定不能与Y的最高价氧化物对应的水化物发生反应 |
| B、Z、W形成的化合物中只有一种类型的化学键 |
| C、Y、Z的氢化物的稳定性Y<Z |
| D、X的原子半径一定小于Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com