
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
分析 A.烧碱和氢氧化钡都是强电解质,在水溶液里完全电离,且烧碱是一元碱,氢氧化钡是二元强碱;
B.硫化钾为强碱弱酸盐,硫离子水解导致数目减少;
C.醋酸为弱电解质,浓度不同,电解程度不同;
D.HCl是强酸,完全电离,醋酸为弱酸部分电离.
解答 解:A.烧碱和氢氧化钡都是强电解质,在水溶液里完全电离,pH相等的两种碱溶液中氢氧根离子浓度相等,因为烧碱是一元强碱碱,氢氧化钡是二元强碱,所以烧碱与Ba(OH)2溶液的物质的量浓度之比2:1,故A正确;
B.因为S2-会水解,导致硫离子数目减少,c(K+)与c(S2-)的比值会大于2,故B错误;
C.醋酸是弱电解质,浓度越高,电离度越低,所以两溶液中氢离子浓度之比小于2,故C错误;
D.HCl是强酸,完全电离,10mL 0.5mol•L-1的盐酸溶液,n(H+)=5×10-3mol,醋酸为弱酸部分电离5mL 0.5mol•L-1的醋酸溶液中的n(H+)<2.5×10-3mol,比值会大于2,故D错误;
故选A.
点评 本题考查较为综合,涉及电解质的强弱以及盐类水解知识,题目难度中等,注意掌握弱电解质的电离平衡及其影响,易错点为C,注意醋酸是弱电解质,浓度越高,电离度越低.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
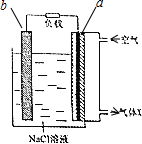 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,溶液中c(OH-)降低 | B. | 加入少量NaOH固体,c(CO32-)增大 | ||
| C. | c(Na+)═2c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)═2c(CO32-)+2c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com