
【题目】几种物质的下列应用体现其还原性的是
A.铁粉作食品袋内的脱氧剂B.氢氧化铝作胃酸中和剂
C.水玻璃用作木材防火剂D.ClO2用于自来水消毒
科目:高中化学 来源: 题型:
【题目】有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(假设过程中所有发生的反应都恰好完全进行)。

试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为______。
(2)在混合物A里,上述四物质中肯定不存在的物质是_____(写化学式)。
(3)在溶液F中,主要含有___种溶质,其中大量含有的酸根离子符号是____。
(4)写出1个生成白色沉淀G的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的离子方程式为:________________,该盐酸的物质的量浓度为___________mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目:___________________________。
(3)8.7gMnO2与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______。
(4)浓盐酸在反应中显示出来的性质是__________(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1。则相同条件下破坏1mol NO分子中的化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:

下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图 1 所示),并测定电离平衡常数 Kb。
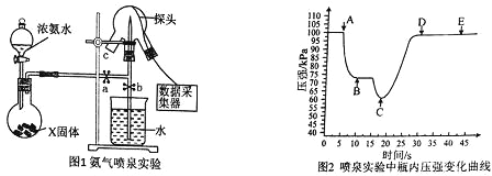
(1)实验室可用浓氨水和X 固体制取 NH3,X 固体可以是_____。
A.生石灰 B.无水氯化钙 C.五氧化二磷 D.碱石灰
(2)检验三颈瓶集满NH3 的方法是:_____。
(3)关闭 a,将带有装满水的胶头滴管的橡皮塞塞紧 c 口,_________,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图 2 所示。图 2 中_____点时喷泉最剧烈。
(4)量取收集到的氨水 20.00 mL,测得 pH=11.0。不断滴加 0.05000 mol/L 盐酸,当盐酸体积为22.50 mL 时恰好完全反应。计算 NH3H2O 电离平衡常数 Kb 的近似值,Kb ≈_____。
II.已知 1 mol SO2(g)氧化为 1 mol SO3 的ΔH= -99kJ·mol-1 请回答下列问题:
(1)已知单质硫的燃烧热为 296 kJ·mol-1,计算由 S(s)生成 3 mol SO3(g)的 ΔH =_____。
(2)在量热计中(如图)将 100 mL 0.50 mol/L 的 CH3COOH 溶液与100 mL 0.55 mol/L NaOH 溶液混合,温度从 298.0 K 升高到 300.7 K。已知量热计的热容常数(量热计各部件每升高 1 K 所需要的热量)是150.5 J/K,溶液密度均为 1 g/mL,生成溶液的比热容c=4.184 J/(g·K)。则 CH3COOH 的中和热ΔH=_____。
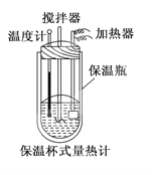
(3)CH3COOH 的中和热的文献值为-56.1 kJ/mol,你认为(1)中测得的实验值偏差可能的原因是(填二点)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com