
| A. | Cr2O72-不能将SO2氧化 | B. | 还原性:Cr3+>Fe2+>SO2 | ||
| C. | 氧化性:Cr2O72->Fe3+>SO2 | D. | 两个反应中Fe3+均表现还原性 |
分析 SO2+2Fe3++2H2O═SO42-+4H++2Fe2+中,S元素的化合价升高,Fe元素的化合价降低;
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O中Cr元素的化合价降低,Fe元素的化合价升高,
由氧化剂的氧化性大于氧化产物的氧化性可知氧化性:Cr2O72->Fe3+>SO2,由还原剂的还原性大于还原产物的还原性可知还原性:Cr3+<Fe2+<SO2,以此来解答.
解答 解:A.氧化性:Cr2O72->Fe3+>SO2,还原性:Cr3+<Fe2+<SO2,则Cr2O72-能将SO2氧化,故A错误;
B.由上述分析可知,还原性:Cr3+<Fe2+<SO2,故B错误;
C.由氧化剂的氧化性大于氧化产物的氧化性可知氧化性:Cr2O72->Fe3+>SO2,故C正确;
D.第一个反应中Fe3+得到电子被还原,第二个反应中Fe3+为氧化产物,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

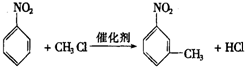 .
.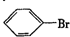 ,②
,②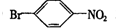 .
.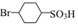 反应的化学方程式
反应的化学方程式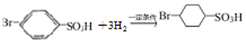 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
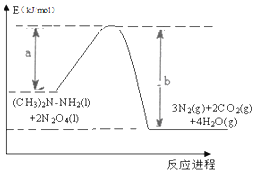 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| C. | 若①2H2(g)+O2(g)═2H2O(g)△H=-akJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H=-bkJ•mol-1,则 a>b | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com