

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.0 |
| 10=14 |
| 10-9 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
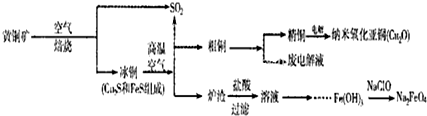
| ||
| ||
n(SO
| 91:9 | 1:1 | 1:91 | ||||
| PH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )
有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )| A、X元素位于ⅥA |
| B、热稳定性:B>C |
| C、C极易溶于B中,溶液呈碱性 |
| D、A和C不可能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含H2CO3的溶液:H2CO3═2H++CO32- |
| B、极少量Fe(OH)3溶于水:Fe(OH)3?Fe3++3OH- |
| C、醋酸溶液:CH3COOH??H++CH3COO- |
| D、NaHSO4溶于水:NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com