
【题目】将标准状况下的![]() LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是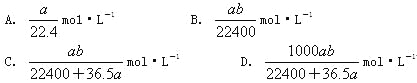
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,溶质的质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A. 溶质的质量分数w=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol·L-1+c(H+)
mol·L-1+c(H+)
D. 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中,在标准状况下放出1.12LH2 。求:
(1)样品中金属钠的质量为____________克.
(2)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为_______mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法正确的是

A. 当n(Cl2)<M mol时,发生的离子反应:2Br-+Cl2=Br2+2Cl-
B. 当n(Cl2)=M mol时,离子浓度关系:c(Fe3+):c(Br-):c(Cl-)=2:1:1
C. 当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D. 当Br-开始被氧化时,通入Cl2的物质的量大于原FeBr2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯装置,请根据装置回答问题:
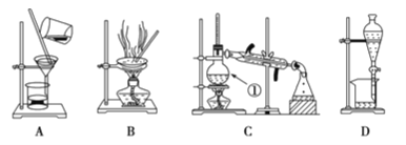
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_______,装置C中冷凝水从____通入。
(2)装量C中①的名称是________,装置D中的分液漏斗在使用之前应该进行的操作为__________,在分液时为使液体顺利滴下,应进行的操作为________________________。
(3)青蒿素是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯的一种无色针状晶体,是一种高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。
已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
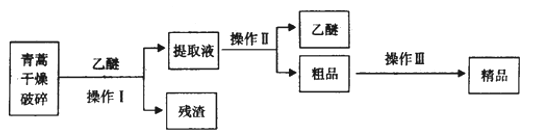
若要在实验室模拟上述工艺,操作Ⅰ选择的装置是_______,操作Ⅱ的名称是________,操作Ⅲ的主要过程可能是_______(填字母)
A. 加95%的乙醇,浓缩、结晶、过滤
B. 加水溶解,蒸发浓缩、冷却结晶、过滤
C. 加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,A和I都是金属单质,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
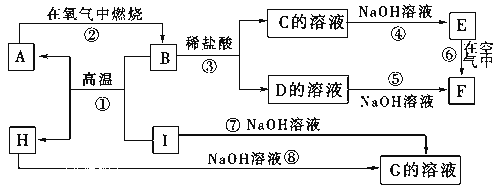
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择装置,完成实验。

(1)用饱和食盐水除去氯气中的氯化氢,应选用______(填序号,下同)。
(2)除去食盐水中的泥沙,应选用______。
(3)用自来水制取蒸馏水,应选用______。
(4)用四氯化碳提取碘水中的碘,应选用______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com