
【题目】取100 mL 0.3 mol/L和300 mL 0.25 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 ( )
A. 0.21 mol/L B. 0.42 mol/L C. 0.56 mol/L D. 0.26 mol/L
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 . 对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 molL﹣1s﹣1
B.分别用B,C,D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0.3 molL﹣1min﹣1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 将Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH+OH-![]() NH3↑+H2O
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO+NH
D. 用稀硝酸洗涤试管内壁上附着的银:Ag+2H++NO===Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或应用与胶体性质无关的是()。
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘。
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
D. 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+Cu2++5Fe2++2S.
(1)该反应中,Fe3+体现性.
(2)上述总反应的原理如图1所示.负极的电极反应式是 .
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10molL﹣1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,再加入少量0.0005molL﹣1 Ag2SO4溶液 | 98.0 |
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是 .
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005molL﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中 , 证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示: 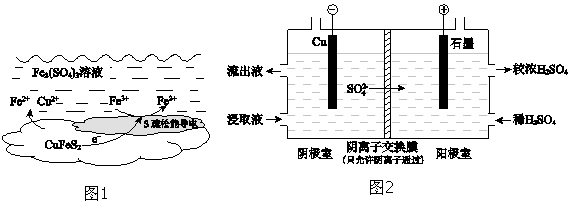
①电解初期,阴极没有铜析出.用电极反应式解释原因是 .
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
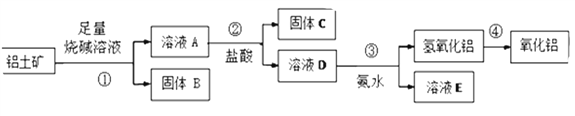
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com