
| A. | 氧化铝 | B. | 金刚石 | C. | 二氧化碳 | D. | 二氧化硅 |
科目:高中化学 来源: 题型:填空题
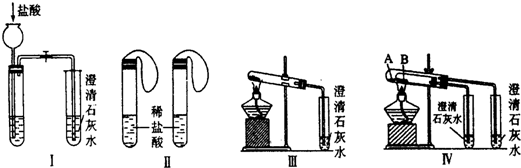
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
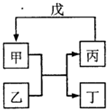 甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( )
甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
| D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸、空气、小苏打、乙醇 | B. | 生石灰、漂白粉、铁、二氧化硫 | ||
| C. | 明矾、盐酸、碳酸钙、氯气 | D. | 冰水混合物、氨水、纯碱、干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com