
| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电解质必须为化合物;
B.氧化铝的熔点高;
C.溶度积小的先生成沉淀;
D.SO2通入含HClO的溶液中,生成H2SO4,发生氧化还原反应.
解答 解:A.氯水中含自由移动的离子可以导电,但氯气为单质,不属于电解质,故A错误;
B.铝箔在酒精灯火焰上加热熔化但不滴落,是因铝箔表面氧化铝熔点高于铝,像网兜一样包裹在Al的外面使其不滴落,故B正确;
C.先出现蓝色沉淀为氢氧化铜,可知Ksp[Mg(OH)2>Ksp[Cu(OH)2],故C错误;
D.SO2通入含HClO的溶液中,生成H2SO4,发生氧化还原反应,不能比较酸性的强酸,实际上硫酸为强酸,而HClO为弱酸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、反应原理等为解答的关键,注意实验的评价性分析,侧重电解质、沉淀生成、氧化还原反应及酸性比较等知识考查,综合性较强,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
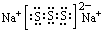 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 原色性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的原子轨道且各种原子轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
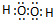 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
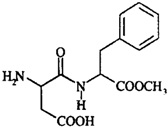 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )| A. | 阿斯巴甜属于糖类 | |
| B. | 在一定条件下完全水解,产物中有两种氨基酸 | |
| C. | 既能与酸反应又能与碱反应 | |
| D. | 可发生取代反应和加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com