
Li~SO2电池具有输出功率高且低温性能好特点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动.电池总反应式为:2Li+2SO2 Li2S2O4下列有关电池的说法正确的是()
Li2S2O4下列有关电池的说法正确的是()
A. 该电池总反应为可逆反应
B. 充电时阴极反应式为:Li++e﹣═Li
C. 放电时Li+向负极移动
D. 该电池电解质溶液可换成LiBr水溶液
考点: 化学电源新型电池.
专题: 电化学专题.
分析: A、根据二次电池的工作原理结合可逆反应的特点来回答;
B、电解池的阴极发生得电子的还原反应;
C、原电池中,阳离子移向正极;
D、金属锂可以和水发生反应.
解答: 解:A、二次电池的充电过程是电解原理,放电过程是原电池原理,两种电池的工作条件不一样,不属于可逆反应,故A错误;
B、充电时是电解池原理,电解池的阴极发生得电子的还原反应,即Li++e﹣═Li,故B正确;
C、放电时是原电池原理,原电池中,阳离子移向正极,即Li+向正极移动,故C错误;
D、由于金属锂可以和水发生反应,所以该电池电解质溶液不可换成LiBr水溶液,故D错误.
故选B.
点评: 本题考查学生二次电池的工作原理知识,可以根据教材知识来回答,注意平时知识的积累是解题的关键,难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
某待测液中只可能含有Ag+、Fe2+、Fe3+、Na+、Ba2+、CO32﹣、NO3﹣、SO42﹣中的几种离子,依次进行如下实验:
①取少量待测液,加入足量的NaCl溶液,无明显现象.
②继续加入足量的Na2SO4溶液,有白色沉淀生成.
③过滤,取少量滤液,加入足量NaOH溶液,有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色.
根据实验现象回答:
(1)待测液中一定含有离子 ,一定没有离子 .
写出步骤②中发生反应的离子方程式 ,写出步骤③中沉淀由白色变为红褐色的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是()
A. 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑
B. 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+
C. NaHCO3溶液与稀H2SO4反应:CO32﹣+2H+═H2O+CO2↑
D. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①O2②三氯甲烷③CH3CH2CH2OH④O3⑤CHCl3 CH3OCH2CH3⑦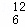 C ⑧CH3CH(OH)CH3⑨
C ⑧CH3CH(OH)CH3⑨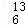 C ⑩CH3OH.
C ⑩CH3OH.
其中属于同系物的有 (填序号,下同),
互为同分异构体的有 ,
互为同素异形体的有 ,
属于同位素的有 ,
是同一种物质的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是()
A. 硫酸铝溶液中加入过量氨水:Al3++3OH﹣═Al(OH)3↓
B. 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32﹣═CaCO3↓+2OH﹣
C. 冷的氢氧化钠溶液中通入氯气:Cl2+2OH﹣═ClO﹣+Cl﹣+H2O
D. 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO42﹣、Na+、CO32﹣、H+、NO3﹣、NH4+、Cl﹣ 等离子中的若干种.然后又做了如下实验,以确认这些离子是否大量存在.
①用pH试纸测溶液的pH,试纸显红色;
②取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀;
③对②中所得混合物充分静置后,取上层清夜用硝酸银溶液和稀硝酸检验,结果又生成了白色沉淀;
④另取2毫升溶液,加入足量氢氧化钠溶液并加热,没有产生能使湿润红色石蕊试纸变蓝的气体.
试回答下述问题:
(1)原溶液中一定存在的离子是
(2)原溶液中一定不存在的离子是
(3)按上述操作,原溶液中还不能肯定是否存在的阳离子是Na+检验该阳离子方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com