
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |
分析 50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,以此解答.
解答 解:50mL 1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A.150 mL 1 mol•L-1 NaCl溶液,溶液中Cl-浓度为1mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故A不选;
B.75ml 2mol/L的CaCl2溶液中Cl-浓度为4mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故B不选;
C.150mL 3 mol•L-1 KCl溶液,溶液中Cl-浓度为3mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度相等,故C选;
D.75 mL 3 mol•L-1 FeCl3溶液,溶液中Cl-浓度为9mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故D不选;
故选:C.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | X和M的最高正价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
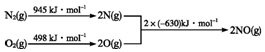
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
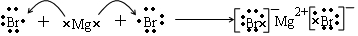 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
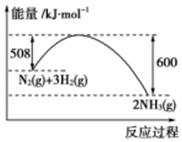 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com