

| A. | 分子式为C10H19O | |
| B. | 同分异构体可能属于醛类、酮类或酚类 | |
| C. | 能发生取代、氧化、还原反应 | |
| D. | 与氢气加成后的产物有4种一氯化物 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
. .
. .
.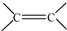 和
和 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:Y<W | |
| B. | 简单离子的半径:W>Y>Z>X | |
| C. | W的氧化物对应的水化物是一种强酸 | |
| D. | 与Z同族的下一周期元素的单质不能与N2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量一定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化等物质的量甲醛(反应①)和甲酸时转移电子的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com