
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
科目:高中化学 来源: 题型:解答题
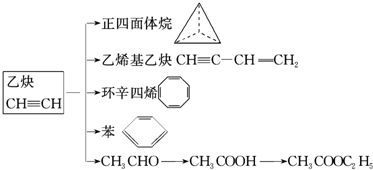
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2COOH既可发生取代反应,也可发生加聚反应 | |
| B. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 酸性条件下CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 2 mol•L-1的醋酸钠溶液中CH3COO- 的数目小于2NA | |
| B. | 常温常压下,1.12 L O2气体所含原子数为0.1NA | |
| C. | 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA | |
| D. | 1 mol羟基含有的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com