
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:
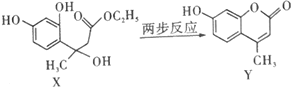
下列说法错误的是( )
A.Y的分子式为C10H8O3
B.由X制取Y过程中可得到乙醇
C.一定条件下,Y能发生加聚反应
D.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3:2
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+,2CH3COOH +2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为______。
(2)NH3分子空间构型为_______, 其中心原子的杂化类型是______。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_______,1mol CH3COOCH=CH2中含![]() 键数目为_____。
键数目为_____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为__________。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
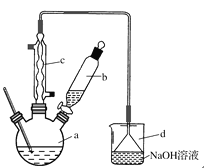
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的是( )
①环丙烷和乙烯的最简式相同②相同质量的乙炔和苯充分燃烧耗氧量相同
③苯乙烯和丁烯互为同系物④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数的值)
⑥![]() 分子中所有原子一定都在同一平面上
分子中所有原子一定都在同一平面上
A. ①②③B. ②④⑤⑥
C. ①②④D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )、环氧丙烷(
)、环氧丙烷(![]() )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①![]()
![]()
②2![]()
![]()
![]()
③![]()
![]()
![]()
![]() _____
_____![]()
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为____,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____(填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____。
③该反应的平衡常数K_____(精确到0.01)。
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____。
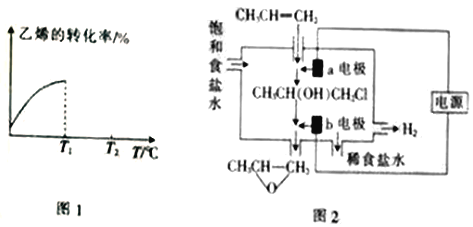
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______。
②b电极区域生成环氧丙烷的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为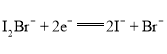
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.铅蓄电池正极反应式:PbO2 + 2e- + 4H+ + SO![]() = PbSO4↓ + 2H2O
= PbSO4↓ + 2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
D.Na2CO3溶液水解:CO![]() + 2H2O
+ 2H2O![]() H2CO3 +2OH-
H2CO3 +2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com