
| A. | Na+、Mg2+、Al3+的氧化性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | ||
| C. | H2S、H2O、HF的稳定性依次增强 | D. | H4SiO4、H2SO4、HClO4酸性依次增强 |
分析 A.根据元素周期律的递变规律判断对应元素金属性的强弱,元素的金属性越强,单质的还原性越强,阳离子的氧化性越弱;
B.根据元素周期律的递变规律判断对应元素金属性的强弱,元素的金属性越强,对应最高价氧化物的水化物的碱性越强;
C.根据元素周期律的递变规律判断对应元素非金属性的强弱,元素的非金属性越强,对应的氢化物越稳定;
D.根据元素周期律的递变规律判断对应元素非金属性的强弱,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强.
解答 解:A.金属性:Al<Mg<Na,元素的金属性越强,单质的还原性越强,阳离子的氧化性越弱,Na+、Mg2+、Al3+的氧化性依次增强,故A错误;
B.金属性:Mg<K<Rb,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:Mg(OH)2<KOH<RbOH,故B正确;
C.非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>H2S,故C正确;
D.非金属:Cl>S>Si,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H4SiO4,故D正确;
故选A.
点评 本题考查元素性质的递变规律,题目难度不大,注意金属性和非金属性与对应单质、化合物的性质的联系.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 18mol/L的浓硫酸15mL L | B. | 0.2mol/L的盐酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的盐酸15m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应 | B. | 苯和液溴反应生成溴苯 | ||
| C. | 乙烯和溴的四氯化碳溶液反应 | D. | 乙酸和乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
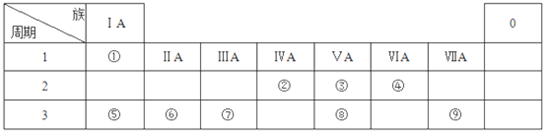
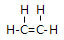 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为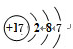 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

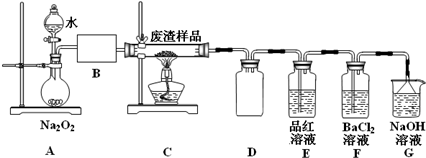
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.
已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶中的水垢 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 | |
| C. | 氢氧化铝可用于治疗胃酸过多 | |
| D. | 为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用苯萃取四氯化碳中的碘 | |
| B. | 苯滴入溴水中,发生取代反应生成溴苯 | |
| C. | 可用石蕊溶液区分乙醇和乙酸两种物质 | |
| D. | 等物质的量的甲烷与氯气混合光照至充分反应,产物中最多的是四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com