
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
分析 A.乙烯和丙烯的最简式为CH2,根据最简式计算;
B.根据质量守恒定律判断发生反应,然后计算出电解时生成气体总物质的量;
C.氢氧化钠固体溶解过程中放出热量,应该冷却后再转移到容量瓶中;
D.二氧化氮与四氧化二氮中存在转化平衡.
解答 解:A.42g乙烯和丙烯的混合气体中含有3mol最简式CH2,含有3mol碳原子,含有3碳原子数为3NA,故A正确;
B.以惰性电极电解CuSO4溶液的电解原理方程式是:2Cu2++2H2O=2Cu+4H++O2↑,加入0.1molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.1mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.1mol时,则生成气体0.05mol,当电解掉0.1mol水时,生成气体0.15mol,共生成0.2mol气体,标准状况下气体体积为4.48L,故B错误;
C.把NaOH固体于烧杯中充分溶解后应冷却至室温再转移至容量瓶,故C错误;
D.30g的NO与O2于密闭容器中充分反应,产物生成二氧化氮,与四氧化二氮相互转化,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:推断题
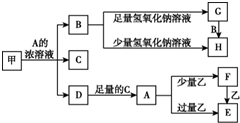 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
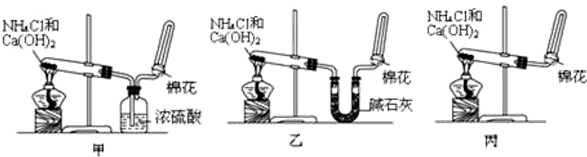
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
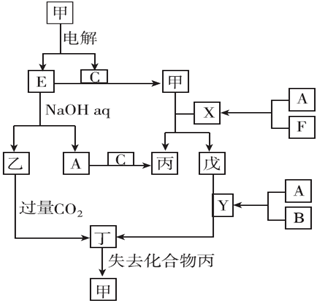
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若(a+b)<(c+d),则反应一定能自发向右进行 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量大于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中可用PH试纸准确测定其PH值 | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com