
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
【答案】D
【解析】
A.由图可知,总反应为水分解生成氢气和氧气,实现了光能向化学能的转化,反应的方程式为2H2O![]() 2H2↑+O2↑,故A正确;
2H2↑+O2↑,故A正确;
B.过程I为2molH2O分子变成2mol氢原子和2mol羟基的过程,吸收的能量=463 kJ×2=926 kJ,故B正确;
C.过程II为2mol氢原子和2mol羟基生成1mol氢气和1mol过氧化氢,放出的能量=436 kJ +138kJ=574 kJ,故C正确;
D.过程Ⅲ为1mol过氧化氢变成1mol氧气和1mol氢气,断开1molH2O2中2molH—O键和1molO—O键,形成1molO2中O=O 键和1molH2中H—H键,吸收的能量=463 kJ×2 +138 kJ =1064kJ,放出的能量=496 kJ +436 kJ =932 kJ,吸收的能量大于放出的能量,该过程为吸热反应,故D错误;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):
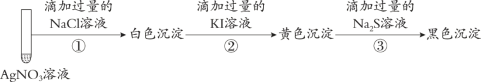
下列说法不正确的是
A. 实验①白色沉淀是难溶的AgCl B. 由实验②说明AgI比AgCl更难溶
C. 若按①③顺序实验,看不到黑色沉淀 D. 若按②①顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的一组是( )
A. 甘油和乙醇互为同系物
B. CH2=CHCH2CH3 和 CH3CH=CHCH3 互为同分异构体
C.  是同一种物质
是同一种物质
D. O2 和 O3 互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X2(g)+Y2(g)![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.4mol·L-1
B.X2为0.2 mol·L-1
C.Y2为0.4 mol·L-1
D.Z为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()
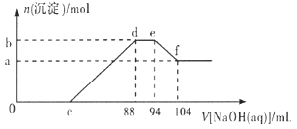
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
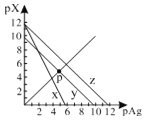
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通人HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是
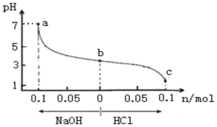
A.X<0.1
B.b→a过程中,水的电离程度逐渐增大
C.Ka (CH3COOH) =10-8/(X-0.1)
D.b→c过程中,c(CH3COOH)/c(CH3COO) 逐渐变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
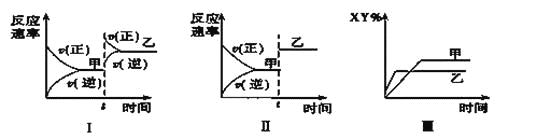
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com