
铝元素在自然界中主要存在于铝土矿(主要成分为A12O3,还含有Fe2O3、FeO、SiO2) 中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
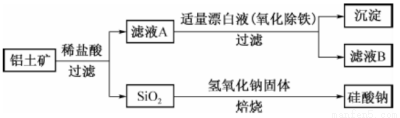
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:

②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

科目:高中化学 来源:2017届湖南省长沙市高三上月考二化学试卷(解析版) 题型:实验题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
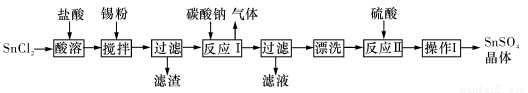
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作I是____________。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:__________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2;
②加入过量的FeC13;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2+ K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
取1.226g锡粉,经上述各步反应后共用去0.100mol/L K2Cr2O7溶液32.0mL。锡粉中锡的质量分数是________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据下表信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价( )
元素代号 | G | L | M | Q | R | T |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104[ | 0.075 | 0.066 |
主要化合价 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.单质的还原性:G<L<M B.非金属性:T<Q
C.气态氢化物的稳定性:R>T D.L2+与T2﹣的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上9月月考化学试卷(解析版) 题型:填空题
NaNO2外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①碘化钾淀粉试纸 ②淀粉 ③白酒④食醋,你认为应选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式 Al+ NaNO3+ NaOH— N aAlO2+ N2↑+ H2O,若反应过程中转移5mol电子,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上9月月考化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关.对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释 |
A | 用铁制容器盛装浓硫酸 | 常温下,铁在浓硫酸中钝化 |
B | 氧化铝可用作耐火材料 | 氧化铝是两性氧化物 |
C | 液氨可用作制冷剂 | 液氨汽化时要吸收大量的热 |
D | “84”消毒液可用于环境消毒 | 主要成分是NaClO,具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设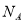 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,7.8g Na2S和Na2O2的混合物中,阴离子所含电子数为1.8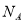
B.标准状况下,11.2LSO3中含有的分子数目为0.5 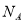
C.常温常压下,46gNO2与 N2O4的混合气体含有的氮原子数目无法计算
D.0.1 mo1 • L-1 MgC12溶液中含有的Mg2+数目小于0.1 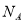
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验方案中,不能测定Na2CO3和 NaHCO3混合物中Na2CO3量分数的是( )
A.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物充分加热,减重b克
C.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) 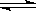 cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
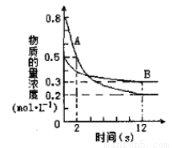
A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
对氧化还原反应: (未配平)的叙述正确的是:
(未配平)的叙述正确的是:
A.若 ,则每生成1molCuI转移6mol电子
,则每生成1molCuI转移6mol电子
B.若 ,则每生成1molCuI转移12mol电子
,则每生成1molCuI转移12mol电子
C.CuI既是氧化产物又是还原产物
D.HI只体现了还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com