
| m |
| M |
| n |
| V |
| n |
| V |
| 20g |
| 40g/mol |
| 0.50mol |
| 0.500L |
| 100mL |
| 500mL |
| 1 |
| 2 |
| 0.050mol |
| 1mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、使用催化剂不改变反应速率 |
| B、改变温度对反应速率无影响 |
| C、升高温度能加快反应速率 |
| D、使用催化剂能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
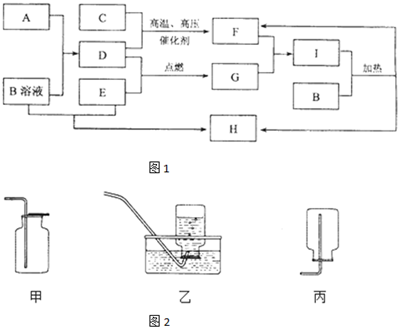
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| NaOH溶液 |
| 盐酸 |
| 适量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
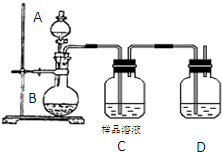 某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 滴定前读数 | 滴定末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com