
 .
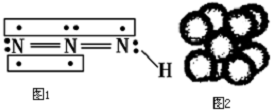
.
分析 (1)A.HNO2为弱酸,而HNO3是强酸;
B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化;
C.HN3、H2O中都有孤电子对,所以都是极性分子;
D.氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键.
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价,SO42-中S原子采用sp3杂化方式,可知SO2-4的立体构型为正四面体,根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)A.NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大;
B.钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2;
C.氮原子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧;
D.氮气常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关.
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出等电子体的分子;根据共价化合物的电子式书写方法分析.
解答 解:(1)A.HNO2为弱酸,而HNO3是强酸,故A错误;
B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C.HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D.氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为:CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO42-中S原子采用sp3杂化方式,可知SO42-的立体构型为正四面体;26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,硫氰化铁为血红色;.
故答案为:+3;正四面体;4;血红色;
(3)A.NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故A错误;
B.钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×$\frac{1}{8}$+1=2,故B正确;
C.子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D.常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为:BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为CO2、BeCl2等,二氧化碳为共价化合物,其电子式为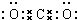 ,
,
故答案为:CO2;BeCl2;  .
.
点评 本题考查了原子的杂化方式、分子的空间结构、等电子体、电子式等,具有一定的综合性,对学生综合能力有一定的要求,题目中等难度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 (1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.
(1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应类型取代反应
反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存浓硝酸时,通常用棕色瓶并放在阴凉处 | |
| B. | 用锌与硫酸反应制取氢气时,适当增大硫酸溶液的浓度 | |
| C. | 合成氨的反应中,选择“铁触媒”作催化剂 | |
| D. | 在试管中进行铝和氢氧化钠溶液反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )| A. | > | B. | = | ||
| C. | < | D. | 条件不足,无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com