
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
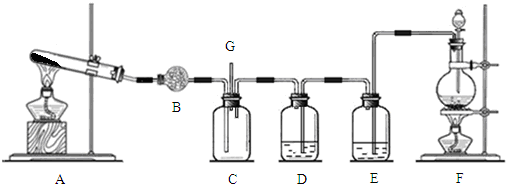
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
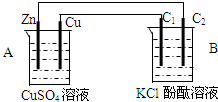 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
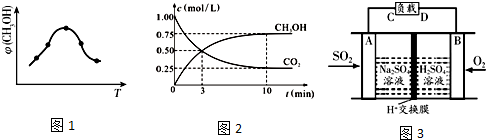
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
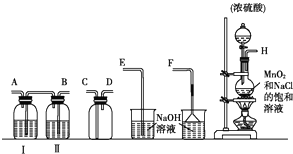
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入澄清石灰水中. | (1)若澄清石灰水未见浑浊,则假设1成立; (2)若澄清石灰水变浑浊,则假设2或3成立. |
| ② | 向步骤①反应后的试管中滴入1~2滴品红溶液,振荡(或另外取样操作) | 结合实验①中的(2), (1)若品红褪色,则假设3成立; (2)若品红不褪色,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
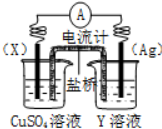 如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2
如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
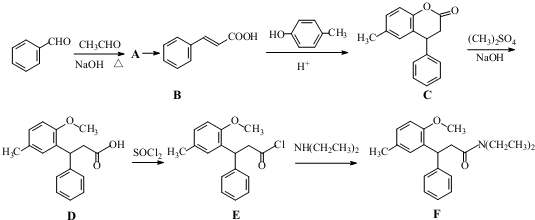
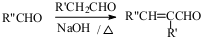
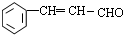 .
.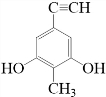 等.(任写一种)
等.(任写一种) )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120mL | B. | 150mL | C. | 200mL | D. | 220mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
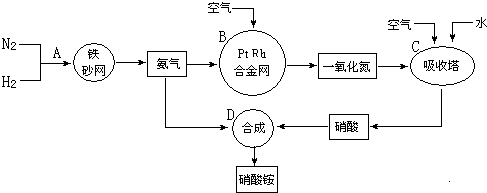

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com