

分析 制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水;
(2)根据实验的需要结合大气压强原理来回答;
(3)制备氮化铝需制备氮气,所以首先要检验装置的气密性;
(4)实验必须对有毒气体进行尾气处理,防止空气污染,CO有毒;
(5)氮化铝和氢氧化钠反应会生成氨气,氨气进入广口瓶后,如果装置密闭,广口瓶中压强会增大,那么就会有水通过广口瓶的长管进入量筒中,根据等量法可知,进入到广口瓶中水的体积就等于生成的氨气的体积.所以通过量筒中排出的水的体积就可以知道氨气的体积,然后有氨气的密度求出氨气的质量,进而根据方程式求出氮化铝的质量.
①产生的氨气极易溶于水,为防止氨气溶于水需要把气体与水隔离,因此应选择不能与氨气产生作用的液体作为隔离液;选用的试剂应是和水不互溶,且密度大于水的;
②反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中充入的氨气当成开始时的空气即可;
③根据氨气的体积计算出物质的量,得出其中氮原子的物质的量,根据氮原子守恒,来计算氮化铝的百分含量.
解答 解:(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,
故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,
故选c;
(3)制备氮化铝通过Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO实现,先需用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,制备装置不能漏气,所以按图连接好实验装置后的下一步操作是检查装置的气密性,方法为:关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,
故答案为:检查装置的气密性;
(4)CO有毒,实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,所以实验装置存在不足为没有尾气处理装置,
故答案为:没有尾气处理装置;
(5)①酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离,
故答案为:C;
②本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,
故答案为:不变;
③氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
$\frac{6.15}{10}$×100%=61.5%,
故答案为:61.5%.
点评 本题考查对实验原理的理解与实验操作评价、物质含量测定、化学计算等,题目难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.


科目:高中化学 来源: 题型:选择题
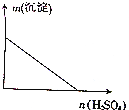 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com