
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下,钛不和非金属、强酸反应;红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一称金红石(TiO2)目前大规模生产钛的方法是:
第一步:金红石、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式是______________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)此反应的化学方程式是__________________。
(2)简述由上述所得产物中获取金属钛的步骤______________。
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题
(12分)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
提示: ①MgCl2晶体的化学式为MgCl2?6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
阅读以下内容,回答问题。
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2,或CO)法;③活泼金属置换法;④电解法。四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为_______(填序号)。
A.O2、CO2 B.O2、CO C.CO2、CO D.CO、CO2
(2)下列说法错误的是_______(填序号)。
A.对废旧金属的最好处理方法是回收再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液制得
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
(3)钛(Ti)有“未来钢铁”之称。工业上常以:TiCl4+2Mg Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
A.稀有气体中 B.空气中 C.氮气中 D.CO2气体中
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: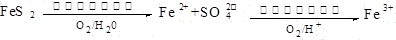
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}= ,实际生产要将γ值维护在1.7—2.2之间, 原因是 。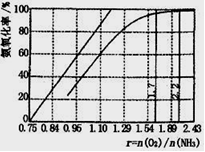
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题: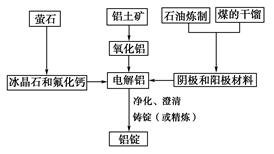
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为: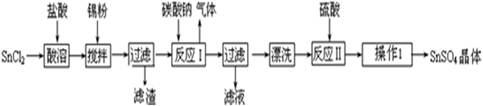
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第 周期(1分)
(2)操作Ⅰ是 过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是
(4)加入Sn粉的作用有两个:①调节溶液pH ②
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 + K2Cr2O7 + HCl = FeCl3 + KCl + CrCl2+ 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com