
【题目】W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中正确的是( )

A.W、X、Z可形成离子化合物
B.Z2O是某种弱酸的酸酐,且为直线型分子
C.W与X形成的二元化合物只能含极性键
D.X、Z形成氧化物对应水化物的酸性:Z>X
【答案】A
【解析】
W、X、Y、Z均为短周期元素且原子序数依次增大,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,则W为H元素,Y应为Al元素;W与Z的最高价之和为8,则Z的最外层电子数为7,其为Cl元素;W、X、Y、Z的原子最外层电子数为互不相等的奇数,则X的最外层电子数为5,其为N元素。
A.W、X、Z分别为H、N、Cl,可形成离子化合物NH4Cl,A正确;
B.Cl2O是某种弱酸HClO的酸酐,因为中心原子O的最外层存在孤电子对,会对共用电子对产生排斥作用,所以分子为V型结构,B不正确;
C.W与X形成的二元化合物若为N2H4,其分子中不仅含有N-H极性键,还含有N-N非极性键,C不正确;
D.X、Z分别为N和Cl,因为没有指明是否为最高价氧化物对应水化物,所以二者的酸性强弱关系无法确定,D不正确;
故选A。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是( )
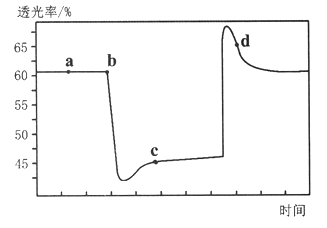
A. b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深
B. c点与a点相比,n(NO2)减小,混合气体密度增大
C. d 点:v(正)<v(逆)
D. 若在注射器中对反应H2(g)+I2(g) ![]() 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图像
2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g),在体积固定的密闭容器中,可确定为平衡状态标志的命题中正确的有( )个
2NO(g)+O2(g),在体积固定的密闭容器中,可确定为平衡状态标志的命题中正确的有( )个
①单位时间内生成nmolO2的同时生成2nmolNO2;
②单位时间内生成nmolO2的同时生成2nmolNO;
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的压强不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态;
⑧绝热容器内温度不再变化;
A.3个B.4个C.5个D.6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用大理石和稀盐酸制取CO2:2H++CO![]() ===CO2↑+H2O
===CO2↑+H2O
B. 碳酸氢钠与烧碱溶液反应:H++CO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
D. 醋酸跟KOH溶液反应:CH3COOH+OH-===CH3COO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。M、N、P、Q分别是这些元素形成的单质,甲、乙、丙、丁、戊是由这些元素形成的二元化合物。其中,乙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丙是一种高能燃料,其组成元素与乙相同;丁是常见的两性氧化物。上述物质的转化关系如图所示。下列说法正确的是( )
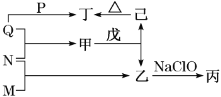
A.原子半径的大小:W<X<Y<Z
B.戊的沸点低于乙
C.丙中只含非极性共价键
D.乙可与X元素的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型: ![]() B.羟基的电子式:
B.羟基的电子式: ![]()
C.乙醛的结构式:CH3CHOD.(CH3)3COH的名称:2,2-二甲基乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):

①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
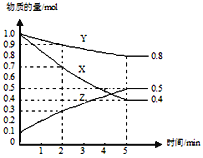
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com