
科目:高中化学 来源: 题型:
控制合适的条件,将反应2Fe3++2I-  2Fe2+I2设计成如下图所示
2Fe2+I2设计成如下图所示
的原电池。下列说法不正确的是
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
某蓄电池反应为NiO2+Fe+2H2O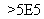 Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3 )以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。
)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。
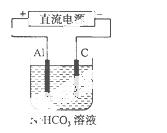
(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中
c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
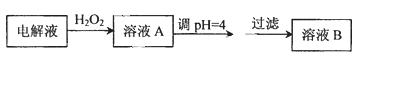
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 |
| 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体通入下列溶液中,能生成白色沉淀且不溶解的是( )
①Ba(OH)2溶液 ②Ba(NO3)2溶液 ③BaCl2溶液
④Ba(ClO)2溶液
A.①② B.①③
C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为_________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填选项字母)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液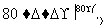 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是__________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是_________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClO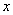 (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。
①D是________(填离子符号)。
②B―→A+C反应的热化学方程式为_______________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期的原子半径及主
要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)。
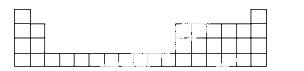
(2)B元素处于元素周期表中________周期________族;
(3)在元素周期表中________的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式);
(5)C、E形成的化合物为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关元素性质的说法不正确的是 ( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2
②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是①
B.具有下列最外层电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D.某元素气态基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.X2-的还原性一定大于Y-
B.由mXa+与nYb-得m+a=n-b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们
的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的
预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是 (  )
)
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高
D.XH4的稳定性比SiH4的高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com