
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和 ,放出28
,放出28 .
. 7kJ的热量
7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下面是生产生活中的常见有机物的分子式?结构(简)式或名称:
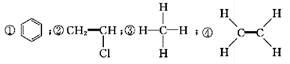
⑤CH3CH2OH;⑥C6H12O6;⑦CH3COOH;⑧硬脂酸甘油酯;⑨蛋白质;⑩聚乙烯。
下列有关说法正确的是( )
A. 能与溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的有⑤⑦⑧⑨
C. 属于高分子材料的有⑧⑨⑩
D. 含碳量最高?有毒?常温下为液体且点燃时有浓的黑烟的是①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则C H3COOH在水溶液中电离的ΔH等于_________
H3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法错误的是
A.增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大
B.决定化学反应速率的主要因素是参加反应的物质的性质
C.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ•mol?1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将 增大。
增大。

(1)根据图 2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
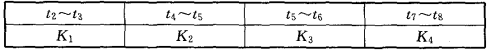
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的 反应是 ( )
反应是 ( )
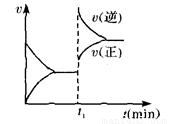
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
B.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com