
����Ŀ��A��B��C��X��Ϊ��ѧ���������ʣ�һ�����������ǵ�ת����ϵ���£�����������ȥ����
A![]() B
B![]() C
C
�Իش�
��1����XΪO2����A��������_____����ѡ���
a��Si b��NH3c��Mg d��S
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��XΪCO2�������ӷ���ʽ����B��Һ�Լ��Ե�ԭ��__________���ٳ�C��һ����;__________��
��3����A��һ�ֻ���ɫ���嵥�ʣ�X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��Ӧ�������û���Ӧ��д����Ӧ���Ļ�ѧ����ʽ___________��C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊ___________��
���𰸡�a��c CO32��+H2O![]() HCO3��+OH�� �Ʒ��ͷۻ�����θ������ 3Cl2+2NH3=N2+6HCl c(Cl��)��c(NH4+)��c(H+)��c(OH��)
HCO3��+OH�� �Ʒ��ͷۻ�����θ������ 3Cl2+2NH3=N2+6HCl c(Cl��)��c(NH4+)��c(H+)��c(OH��)
��������
��1��a.Si��O2������Ӧ�γ�SiO2��SiO2������������������Ӧ���������⣻
b. NH3��O2�ڴ�������ʱ����������Ӧ����NO��NO��O2��Ӧ����NO2������ʵ�����ʵ��ת�������������⣻
c��Mg��O2��Ӧ����MgO��MgO�����ٱ������������������⣻
d��S�������ٵ�ȼʱ����ΪSO2��SO2������������Ӧ����SO3������ʵ������֮����ת�������������⡣
��ѡ����ac��
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��˵������NaԪ�ء�XΪCO2����A��NaOH��B��Na2CO3��C��NaHCO3��Na2CO3��ǿ�������Σ�����Һ��CO32-����ˮ�ⷴӦ������ˮ���������H+���ٽ���ˮ�ĵ���ƽ�������ķ����ƶ��������մﵽƽ��ʱ��c(OH-)��c(H+)��������Һ�Լ��ԣ������ӷ���ʽ����B��Һ�Լ��Ե�ԭ��CO32��+H2O![]() HCO3��+OH����NaHCO3�׳�С�մ�����������θ����࣬��ĭ���������ȡ���ɵ�ʳƷ�ȡ�
HCO3��+OH����NaHCO3�׳�С�մ�����������θ����࣬��ĭ���������ȡ���ɵ�ʳƷ�ȡ�
��3����A��һ�ֻ���ɫ���嵥�ʣ���A��Cl2��X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬X��NH3����Ӧ�������û���Ӧ��,�÷�Ӧ�Ļ�ѧ����ʽ3Cl2+2NH3=N2+6HCl ������ͨ�백����������Ӧ����NH4Cl.������ǿ�������Σ�����Һ��NH4+ˮ������ˮ���������OH-���ٽ���ˮ�ĵ���ƽ�⣬���մﵽƽ��ʱ����Һ��c(H+)��c(OH-)��NH4+ˮ�����ģ�����c(Cl-)��c(NH4+)��������ˮ��̶������ģ��ε������������Ũ��Զ����ˮ����������ӵ�Ũ�ȣ�����c(NH4+)��c(H+)����C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊc(Cl��)��c(NH4+)��c(H+)��c(OH��)��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ̼���ƺ�̼�����ƵĻ����8.22g�����ȵ��������ٷ����仯����ȴ���������Ϊ6.36g���ش��������⣺
��1����ȡ��������ԭ���������ˮ�����80mL��Һ����c(Na+) = ______mol��L-1��
��2����1��������Һ����εμ�1mol��L-1��ϡ���������������ɵ�CO2�������״���£��������������������ͼ��ϵ��������CO2��ˮ�е��ܽ⣩����a��������������Ϊ_______mL��
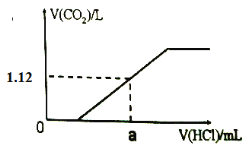
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʽṹ�����ʵı�����ȷ���ǣ� ��
A. ij���Ľṹʾ��ͼΪ ����Ԫ��λ�����ڱ�������������
����Ԫ��λ�����ڱ�������������
B. ��ҵ����![]() �ķ�Ӧ���Ʊ��أ�����Ϊ�Ʊȼظ�����
�ķ�Ӧ���Ʊ��أ�����Ϊ�Ʊȼظ�����
C. ![]() �ķе����
�ķе����![]() �ķе㣬ԭ����
�ķе㣬ԭ����![]() ���Ӽ��������й�
���Ӽ��������й�
D. ����������Һ�У���������Һ�м�����臨��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ְ�ˮú������Ҫ��![]() ��CO��
��CO��![]() ��
��![]() ������
������![]() ����������ת����Ӧ���Ƶúϳɰ�ԭ������
����������ת����Ӧ���Ƶúϳɰ�ԭ������
��1�����ְ�ˮú����������һ��������Ϻ�ͨ��![]() ��
��![]() �Ļ����Һ����ɡ�������ת��������ͼ��ʾ���ù����з��������Ӧ���ܷ�ӦΪ
�Ļ����Һ����ɡ�������ת��������ͼ��ʾ���ù����з��������Ӧ���ܷ�ӦΪ![]() ����ת��������������õ�����Ϊ____��д���ù��������ڷ�������ԭ��Ӧ�����ӷ���ʽ___��
����ת��������������õ�����Ϊ____��д���ù��������ڷ�������ԭ��Ӧ�����ӷ���ʽ___��
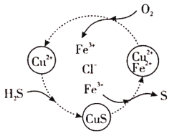
��2�������İ�ˮú����ˮ������1:15������Ϻ�ͨ��ת�����У��任��ӦΪ��![]() ���÷�Ӧ���������������������������������������о����֣��任��Ӧ������������ɣ�
���÷�Ӧ���������������������������������������о����֣��任��Ӧ������������ɣ�
��һ����![]()
![]() ������Ӧ��
������Ӧ��
�ڶ�����![]()
![]() ���췴Ӧ��
���췴Ӧ��
������ͼ�л��Ʊ任��Ӧ������������Ӧ���̣��ġ���������Ӧ���̡�ʾ��ͼ___��
������![]() ��CO��ԭ�Խ�ǿ���ܹ���������ֱ�ӻ�ԭ������ʹ����ʧ���ʵ��������һ�㲻�ᷢ�������������ӷ�Ӧ���ʣ���ѧƽ��ǶȽ��Ϳ��ܵķ�Ӧ����ԭ����____��
��CO��ԭ�Խ�ǿ���ܹ���������ֱ�ӻ�ԭ������ʹ����ʧ���ʵ��������һ�㲻�ᷢ�������������ӷ�Ӧ���ʣ���ѧƽ��ǶȽ��Ϳ��ܵķ�Ӧ����ԭ����____��
��3����ˮú��������õ��Ļ�����У���ͨ��������̼�����о��绯ѧ��ԭ�������еĶ�����̼�����õ��ߴ��ȵ�̼��д������̼�ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����( )
A.�Ȼ�����Һ�м��������İ�ˮ��Al3++3OH-=Al(OH)3��
B.����Ͷ�뵽NaOH��Һ�У�2Al+2OH-=2AlO2-+H2��
C.��NaHCO3��Һ�м�������ij���ʯ��ˮ��2HCO3-+Ca2++2OH-=CaCO3��+2H2O+CO32-
D.��������Һ�м�������������Һ��SO42-ǡ�ó�����Al3++2SO42-+2Ba2++4OH-=2BaSO4��+AlO2-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��ӵ���ϵ�У�ȷ�ϻ�ѧ��Ӧ�Ⱥ�˳�������ڽ�����⣬���л�ѧ��Ӧ�Ⱥ�˳���жϴ������(����)
A.�ں������ʵ�����AlO2-��OH-��CO32-����Һ�У���μ������OH-��CO32-��AlO2-
B.�ں������ʵ�����CO32-��HCO3-����Һ�У���μ������CO32-��HCO3-
C.�ں������ʵ�����K2CO3��KOH����Һ�У���ͨ��CO2��KOH��K2CO3
D.�ں������ʵ�����Fe3+��Cu2+��H+����Һ�м���п�ۣ�Fe3+��Cu2+��H+��Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ��Fe2+��������Ե�ʡ��ش��������⣺
(1)���õ�FeSO4��Һ��Fe3+�ļ��飺����õ�FeSO4��Һ�м���KSCN������Ϊ��______________________________
(2)��ȥ����FeSO4��Һ��Fe3+������Һ�м����������ۣ����Թ۲쵽������Ϊ��______________________����Ӧ�����ӷ���ʽΪ��____________________________
(3)�������ϣ���Һ��Fe2+���������̷�Ϊ������������Fe2+ˮ��ΪFe(OH)2������ˮ����ﱻO2������д��Fe(OH)2�ڿ����б�����������Ϊ_________________________д����ѧ����ʽ������˫���ű�ע����ת�ƣ�________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ǰ�ߺͺ����ʱ������ǰ���Ƿ������������ͬһ����ѧ����ʽ��ʾ���ǣ� ��
A.![]() ��Һ��NaOH��ҺB.ϡ
��Һ��NaOH��ҺB.ϡ![]() ��
��![]() ��Һ
��Һ
C.����ʯ��ˮ��![]() D.��ˮ��
D.��ˮ��![]() ��Һ
��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ���һ�������Դ���⣬����������Щ��Դ�ǿ�ѧ�о�����Ҫ���⡣��ͼΪ��ˮ��Դ���õIJ��ֹ��̣��й�˵������ȷ����

A.��ˮ�����ķ�����Ҫ�������������������ӽ�����
B.�ȼҵ�в��������ӽ���Ĥ����߲�Ʒ�Ĵ���
C.��MgCl2��6H2O�õ���ˮMgCl2�Ĺؼ���Ҫ�ڸ�����Ȼ�����������С����
D.�幤ҵ�Тۡ��ܵ�Ŀ����Ϊ�˸�����Ԫ�أ���Ԫ���ڷ�Ӧ�ۡ��ܡ����о�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com