
分析 (1)结合元素化合价的变化以及质量守恒配平方程式;根据氧化性大于氧化产物判断氧化性强弱;
(2)碘酸钾加热容易分解,热稳定性差;
(3)KIO3的摩尔质量是214g/mol,1.28kg固体的物质的量是6mol;根据化合价升降相等列出碘酸钾和双氧水的关系式:2KIO3~5H2O2;求出双氧水的物质的量,再计算出双氧水溶液的质量.
解答 解:(1)反应中O元素化合价由-1价降低到-2价,则H2O2为氧化剂,I元素化合价由0价升高到+5价,则HIO3为氧化产物,根据得失电子守恒,方程式为5H2O2+I2=2HIO3+4H2O,根据氧化性大于氧化产物,则氧化性强弱:H2O2>HIO3,
故答案为:5;1;2;4H2O;>;
(2)由于碘酸钾的热稳定性较差,烹饪时,含KIO3 的食盐常在出锅前加入;
故答案是:在较高温度下KIO3 易分解;
(3)1.28kg KIO3固体的物质的量是6mol,根据化合价升降相等,I2→IO3-化合价升高5价、H2O2→H2O化合价降低2价,关系式为:2KIO3~5H2O2
n(H2O2)=$\frac{5}{2}$n(IO3-)=$\frac{5}{2}$×6mol=15mol;消耗质量分数为30%的双氧水的质量为:$\frac{15mol×34g/mol}{30%}$=1700g=1.7kg;
故答案是:1.7.
点评 本题考查氧化还原反应的计算,为高频考点,把握实验原理反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与应用、计算能力的考查,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
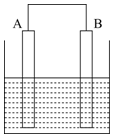
| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 道尔顿:分子学说 | B. | 汤姆生:射线的发现 | ||
| C. | 卢瑟福:原子结构的行星模型 | D. | 伦琴:原子的葡萄干面包模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com