
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
分析 ①常温下,氯气和碱的反应为歧化反应;
②求出18gH2O的物质的量,然后根据水中含10个电子来分析;
③一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
④反应KIO3+6HI═KI+3I2+3H2O转移5mol电子,生成3mol碘;
⑤C2H4和C4H8的最简式均为CH2;
⑥0.5molNO与0.5molO2混合后生成的NO2中存在平衡:2NO2?N2O4;
⑦1.0L 1.0mol•L-1 Na2SiO3水溶液中除了硅酸钠外,水也含氧原子.
解答 解:①常温下,氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1NA个电子,故错误;
②18gH2O的物质的量为1mol,而水中含10个电子,故1mol水中含10NA个电子,故正确;
③一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA,故错误;
④反应KIO3+6HI═KI+3I2+3H2O转移5mol电子,生成3mol碘,即当3mol I2转移的电子数为5NA,故正确;
⑤C2H4和C4H8的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含原子个数为3NA个,故正确;
⑥0.5molNO与0.5molO2混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,则最终分子个数小于0.75NA个,故错误;
⑦1.0L 1.0mol•L-1 Na2SiO3水溶液中除了硅酸钠外,水也含氧原子,故溶液中含有的氧原子的个数多于3NA个,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
某金属加工厂排放的污水中含有CuSO4、ZnSO4、FeSO4,某研究小组利用该污水回收工业重要原料硫酸锌和有关金属,其流程如右图所示:请回答下列问题:
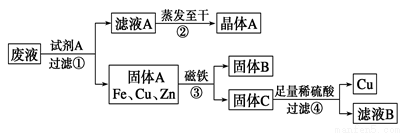
(1)下列说法正确的是________。
A.该工艺流程中发生了3个置换反应
B.CuSO4与MgCl2可以发生复分解反应
C.步骤①②③④都包含化学变化
D.滤液A和滤液B含有相同的溶质
(2)写出步骤①发生反应的离子方程式:_______________、________________。
(3)步骤④中加入足量稀硫酸的目的是________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
2015年5月郴州成功举办了第三届中国(湖南)国际矿物宝石博览会。矿博会上展示了色彩缤纷、形状各异的金属矿物,下列金属的冶炼属于热还原法的是( )
A.2NaCl(熔融)=2Na+Cl2↑
B.WO3+3H2 W+3H2O
W+3H2O
C.Fe+CuSO4=Cu+FeSO4
D.2Ag2O 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
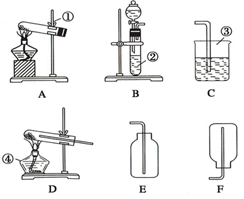 现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)
现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
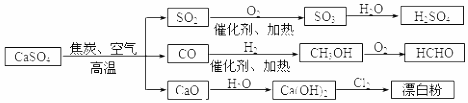
| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下体积一定相同 | B. | 氧原子个数一定相同 | ||
| C. | 分子个数一定相同 | D. | 质量比是22:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com